Витамин D
Витамин D на самом деле гормон, а не витамин. При достаточном солнечном освещении не требуется никаких добавок к диете. Активное начало витамина D синтезируется под метаболическим контролем путем последовательных гидроксилирований в печени и почках и переносится кровью к своим тканям-мишеням (тонкий кишечник и кость), где оно поддерживает гомеостаз кальция. В регуляции метаболизма витамина D в почках основную роль (прямо или косвенно) играют ионы кальция и фосфата, паратиреоидный гормон и, возможно, другие пептидные и стероидные гормоны. Анализ врожденных и приобретенных де(})ектов этих метаболических процессов позволил лучше понять патофизиологию некоторых нарушений обмена кальция и фосфора и метаболизма костной ткани и обусловил прогресс в нескольких областях, включая химический синтез активных метаболитов и аналогов витамина D, клиническое применение 1,25-дигидрокси-витамина D3 [1,25(OH)2D3] при многих резистентных к витамину D состояниях, разработку и внедрение методов определения метаболитов витамина D в крови для подтверждения подозреваемых нарушений его метаболизма, а также создание более активных аналогов витамина D, пригодных для клинического применения.
Фотобиогенез витамина D
Витамин D3 — это производное 7-дегидрохолестерина (провитамин D3), ближайшего предшественника холестерина. При экспозиции кожи к солнечному свету или некоторым искусственным источникам света ультрафиолетовые лучи проникают в эпидермис и вызывают разнообразные фотобиохимичсские сдвиги, в том числе и превращение 7-дегидрохолестерина в витамин D3. Волны длиной 290—315 нм поглощаются конъюгированными двойными связями С5 и С7 7-дегидрохолестерина, что приводит к фрагментации кольца В между С9 и С10 с образованием 9,10-секостерола (секо означает «расщепление») провитамина D3 (рис. 335-4). Провитамин D3 биологически инертен, но термолабилен и спонтанно подвергается зависимой от температуры молекулярной перестройке на участке своей конъюгированной триеновой системы (три двойные связи) с образованием термостабильного 9,10-секостерола, витамина D3 (см. рис. 335-4). При температуре тела полное превращение провитамина D3 в витамин D3 происходит примерно за 3 дня. Резкие изменения температуры поверхности кожи не влияют на скорость этого превращения, так как оно происходит в активно растущих слоях эпидермиса, где температура относительно постоянна; изменения температуры внутренних структур организма также слабо влияют на эту реакцию. После синтеза витамин D3 из эпидермиса переносится в циркулирующую кровь витамин D-связывающим белком. Таким образом, витамин D3 образуется в коже из провитамина D3 в течение нескольких дней после однократного воздействия солнечных лучей (см. рис. 335-4). Хотя меланин конкурирует с 7-дегидрохолестерином в коже за фотоны ультрафиолета и тем самым может ограничивать синтез провитамина D,, более важным для предотвращения избыточного образования провитамина D3 при длительном воздействии солнечного света является, по-видимому, фотохимическая изомеризация провитамина D3 в два биологически неактивных продукта (люмистерол, и тахистерол,).
С возрастом способность кожи производить витамин D3 уменьшается; после 70 лет эта способность снижается более чем вдвое. Защита отдельных участков тела от солнца снижает кожную продукцию витамина D3. На синтез витамина D3 в коже влияет также высота местности над уровнем моря, ее географическое положение, время дня и площадь воздействия света. Когда все тело подвергается воздействию солнечных лучей в дозе, вызывающей легкую эритему, содержание витамина D, в крови увеличивается так же, как после приема внутрь 10 000 ME витамина D3 (1 ME содержит 0,025 мкг химически чистого витамина D). Необходимость в добавках к диете для профилактики нарушений минерализации скелета возникает только тогда, когда облучение кожи недостаточно, чтобы вызвать образование нужных количеств витамина D3. В начале нашего века для лечения рахита широко применяли жир из печени рыб — природный источник витамина D. В настоящее время к молоку и крупам добавляют кристаллические витамины D2 (см. рис. 335-4) или витамина D3. Эти добавки предотвращают рахит и остеомаляцию. Национальный Совет США по Научным исследованиям рекомендует потреблять в день 400 ME витамина D.
Попав в кровь либо путем всасывания из продуктов питания, либо из кожи, витамин D переносится в печень в связанном со специфическим альфа,-глобулином (витамин D-связывающий белок) виде.
Метаболизм витамина D
В печени витамин D под действием митохондриального и/или микросомального фермента (ферментов) превращается в 25-гидроксивитамина D [25(OH)D] (см. рис. 335-4). 25(OH)D—один из основных присутствующих в крови метаболитов витамина D; его период полужизни составляет примерно 21 сут. Концентрацию 25(OH)D и некоторых его метаболитов в сыворотке крови определяют методами конкурентного белкового связывания. Нормальная концентрация 25(OH)D, no данным разных лабораторий, варьирует от 5 до 80 нг/мл. У людей, подвергающихся интенсивному солнечному облучению, концентрация 25(OH)D может достигать 150 нг/мл без какого-либо отрицательного влияния на обмен кальция. Те методы, в которых перед оценкой связывания проводят хроматографическое разделение определяемых соединений, часто дают более низкие показатели «нормы». Это, вероятно, объясняется тем, что белок связывает и другие метаболиты витамина D. Нормальные показатели, явно не зависящие от метода определения, в Великобритании ниже, чем в США; в Великобритании не принято обогащать пищевые продукты витамином D, а солнечных дней там меньше, чем в большинстве районов США. Уровень 25(OH)D в сыворотке крови обычно отражает содержание и 25-гидроксивитамина D2 [25(OH)D2], и 25-гидроксивитамина D3 [25(OH)D3].
Соотношение между этими двумя 25-гидроксилированными производными зависит от относительных количеств витаминов D2 и D3 в пище и количества провитамина D3, образующегося под действием солнечного света.
25-Гидроксилнрование витамина D в печени регулируется механизмом обратной связи. Однако эта регуляция не слишком жесткая: при повышении приема с пищей или эндогенной продукции витамина D3 концентрация 25(OH)D в сыворотке возрастает. При приеме больших количеств витамина D концентрация 25(OH)D может превышать 500 нг/мл. Содержание этого соединения в сыворотке снижается при тяжелых хронических поражениях паренхимы и желчных путей печени (табл. 335-1). 25(OH)D в физиологических концентрациях биологически неактивен, но in vitro в высоких концентрациях активен. В норме после образования в печени 25(OH)D взаимодействует с обладающим высоким сродством витамин D-связывающим белком, который синтезируется в печени и переносится в почки, где происходит еще одно стереоспсцифическос гидроксилирование либо при С1, либо при С24 (см. рис. 335-4). Почки играют важнейшую роль в превращении 25(OH)D в биологически активный метаболит. При гипокальциемии активность почечной митохондриальной 25(OH)D-1-гидроксилазы повышается, и тем самым ускоряется превращение 25(OH)D в 1,25(OH)2D. Однако гипокальциемия может влиять на это гидроксилирование не прямо. Любoe снижение концентрации ионов кальция в сыворотке крови ниже нормы—это стимул к повышению секреции паратиреоидного гормона. Последний в физиологических условиях выступает в роли тропного гормона для проксимальных извитых канальцев почек, где возрастает синтез 1,25 (OH)2D. Механизм, посредством которого паратиреоидный гормон оказывает свое действие на почечный метаболизм 25(OH)D, неизвестен. Однако продукция 1,25(OH)2D почками коррелирует с влиянием паратиреоидного гормона на концентрацию фосфата в крови (и, вероятно, в почечных клетках), которая в таких условиях снижается. Сам 1,25(OH)2D также влияет на метаболизм 25(OH)D в почках, снижая активность 25(OH)D-1-гидроксилазы и повышая метаболизм 24R, 25-дигидроксивитамина D [24,25(OH)2D].
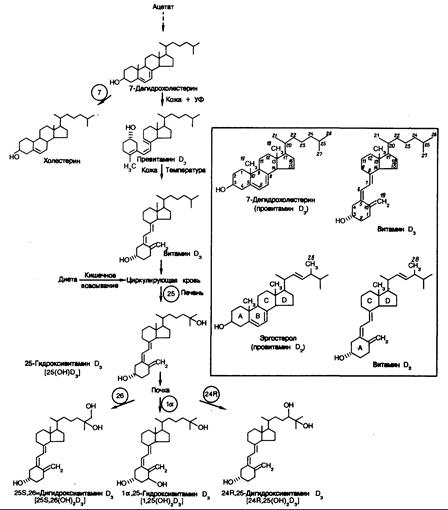
Рис. 335-4. Фотобиогенез и метаболические пути образования и обмена витамина D.
Обозначения:7 — 7-дегидрохолестеринредуктаза, 25 — витамин D-25-гидроксилаза, 1 —
25(OH)D-1-гидроксилаза, 24R — 25(ОН)D—24R.-гидроксилаза, 26 — 25(ОН)D-26-гидроксилаза.
Отдельно (в квадрате) показаны основные 5,7-диеновые стероидные структуры предшественников витамина D, (эргостерол) и витамина D3 (7-дегидрохолестерин), а также 9,10-секостероидные структуры витамина D2 (эргокальциферол) и витамина D3 (холекальциферол).
Цифровые индексы витамина D связаны с порядком, в котором были выделены и охарактеризованы эти соединения. То, что вначале получило название витамин D представляет собой смесь соединений, и в настоящее время это обозначение не применяется. Следующие два вещества группы витамина D — витамин D2 и витамин D3 — были выделены соответственно из продуктов облучения эргостерола (5,7-диеновый стероид первоначально был обнаружен в растениях) и 7-дегидрохолестерина (5,7-диеновый стероидный предшественник холестерина присутствует в тканях животных, включая человека). Витамины D2 и D3 различаются своими боковыми цепями. Боковые цепи витамина D2 содержат 22 и С24-метильную группу.
Хотя витамин D3 — единственная форма витамина D в коже, оба витамина — D2 и D3 — метаболизируются одинаково и обладают равной биологической активностью у большинства млекопитающих. Если у витамина D не стоит цифрового индекса, это обозначение может относиться к любому из двух соединений.
Таблица 335-1. Концентрации 25(OH)D в сыворотке крови при нарушениях обмена кальция и фосфора и метаболизма костной ткани
| Патологическое состояние | Уровень 25 (ОН) D в сыворотке |
| Недостаточность витамина D | Снижен |
| Синдромы нарушения всасывания в кишечнике | » |
| Поражения печени (хронические и тяжелые) | » |
| Нефротический синдром | » |
| Остеопения у пожилых лиц | В норме или снижен |
| Интоксикация витамином D | Повышен |
24,25(OH)2D представляет собой циркулирующий метаболит 25(OH)D, содержание которого в сыворотке в норме колеблется от 0,5 до 5 нг/мл. Он также служит субстратом почечной 25(OH)D-1-гидроксилазы и под ее влиянием превращается в 1,24R,25-тригидроксивитамин D [1,24,25(OH)3D]. Этот трижды гидроксилированный метаболит стимулирует транспорт ионов кальция в кишечнике слабее, чем 1,25(OH)2D. И грает ли он физиологическую роль в поддержании кальциевого гомеостаза, неясно. К клеткам, которые обладают способностью превращать 25(OH)D в 24,25(OH)2D, относятся также культивируемые хондроциты, фибробласты кожи, клетки кишечника и гипофиза. 24,25(OH)2D мог бы иметь значение для экспрессии эффектов витамина D, особенно в костях скелета. Однако по вопросу о биологической значимости самого 24,25(OH)2D вне эффектов, связанных с его превращением в 1,24,25(OH)3D, существуют разногласия.
Почки метаболизируют 25(OH)D и в 25S,26-дигидроксивитамин D [25,26(ОН)2D].Это соединение, подобно 24,25(OH)2D, превращается в почках в 1,25S,26-тригидроксивитамин D [1,25,26(OH)3D], который в отношении индукции транспорта ионов кальция в кишечнике менее активен, чем 1,25(OH)2D, и физиологическая функция которого остается неизвестной.
1,25(OH)2D служит субстратом 25(ОН)D-24R-гидроксилазы и превращается в 1,25,25(OH)3D, но это превращение не имеет решающего значения для проявления биологической активности 1,25(OH)2D. Идентифицировано более 20 метаболитов витамина D. Все они являются производными 25(OH)D или 1,25(OH)2D, и большинство представляет собой продукты деградации витамина. Особое внимание привлекает метаболическая последовательность, обеспечивающая инактивацию 1,25(OH)2D путем окислительного отщепления боковой цепи между С23 и С24 с образованием биологически инертного и водорастворимого соединения — 1-гидроксивитамин D-23-карбоновой кислоты.
В номенклатуре стероидов те заместители на кольцевом скелете, которые ориентированы в пространстве ниже плана молекулы (показано пунктирными линиями), называются -заместителями, а те, которые расположены над планом молекулы (показано сплошными линиями), — -заместителями. Поскольку витамин D это структурное производное -диенового стероида, нумерацию атомов углерода и стереохимические обозначения функциональных групп для удобства оставили теми же, что и в стероиде-предшественнике. В процессе превращения 5,7-диен провитамин D витамин D геометрическое положение кольца А изменяется, что меняет и стереохимическую ориентацию его заместителей; тем не менее сохранены исходные обозначения гидроксильных функций кольца А (как в стероидном предшественнике). Буквы R и S в обозначении вещества (например, 24R,25-дигидроксивитамин D3) указывают на пространственную конфигурацию заместителя по отношению к асимметрическому углеродному центру.
Физиологическая роль витамина D
1,25(OH)2D, продуцируемый почками, а во время беременности и плацентой, — это единственный известный метаболит витамина D, играющий физиологически значимую роль. Возможное значение других метаболитов не установлено. 1,25(OH)2D в комплексе с витамин D-связывающим белком переносится к кишечнику, клетки которого поглощают свободную форму и транслоцируют ее к специфическому рецепторному белку ядра. Взаимодействие 1,25(OH)2D со своим специфическим ядерным рецептором приводит к фосфорилированию рецепторного комплекса, а последующее взаимодействие с хроматином активирует транскрипцию генов, продукты которых стимулируют транспорт ионов кальция и фосфата из просвета тонкого кишечника в кровь. Считают, что в физиологических условиях действие 1,25(ОН)2D синергично действию паратгормона па резорбцию кости. Однако влияние физиологических концентраций 1,25(OH)2D на кость в отсутствие паратиреоидного гормона не установлено. Тем не менее 1,25(OH)2D в сверхфизиологическнх концентрациях способен и независимо от паратиреоидного гормона мобилизовать костные минералы, способствуя дифференцировке моноядерных клеток-предшественников в остеокласты. Обладает ли 1,25(OH)2D прямым эффектом на почечную динамику кальция и фосфора, также неизвестно.
Цитоплазматические рецепторы 1,25(ОН)2D3 присутствуют в кости, клетках почечных канальцев, а также в тех тканях и клетках, которые не принято относить к классическим органам-мишеням этого гормона, в том числе в коже, молочных железах, гипофизе, околощитовидных железах, -клетках островков поджелудочной железы, половых железах, головном мозге, скелетных мышцах, моноцитах крови и активированных В- и Т-лимфоцитах. Хотя физиологическая роль 1,25(OH)2D в этих клетках остается неясной, in vitro он ингибирует пролиферацию фибробластов, стимулирует последний этап дифференцировки кератиноцитов человека; индуцирует продукцию интерлейкина-1 моноцитами и их созревание в макрофаги и остеокластоподобные клетки, угнетает продукцию имтерлейкина-2 Т-лимфоцитами и стимулирует синтез и секрецию тиреотропного гормона (ТТГ) клетками гипофиза. Кроме того, рецепторами 1,25(OH),D обладают клеточные линии разнообразных опухолей, включая рак молочной железы и меланомы, а также промиелобласты.
В культуре клеточные линии опухолей, обладающие рецепторами к этому гормону, реагируют на него снижением скорости пролиферации и повышением степени дифференцированности. Например, при добавлении 1,25(OH)2D3 к злокачественным обладающим рецепторами промиелоцитам человека (HL-60) эти клетки уже через неделю созревают в функционирующие макрофаги. Хотя механизм индукции созревания под действием 1,25(OH)2D3 неизвестен, это вещество уменьшает экспрессию онкогена c-myc, что согласуется с торможением репликации. Однако этот эффект непродолжителен. Если удалить гормон из среды созревающих промиелоцитов HL-60, то клетки возвращаются к своему исходному злокачественному состоянию, а экспрессия онкогена c-myc растормаживается.
Значение 1,25(OH)2D в регуляции дифференцировки и процессов иммунного контроля неизвестно. У больных с витамин D-зависимым рахитом II типа, которые неспособны реагировать на физиологические концентрации 1,25(OH)2D3 (из-за дефицнта или патологии рецепторов этого гормона), явных нарушений клеточного иммунного ответа in vivo не обнаруживается; 1,25(OH)2D3 мог бы индуцировать дифференцировку стволовых клеток костного мозга в остеокласты. .
В большинстве случаев концентрацию 1,25(OH)2D в крови при различных физиологических и патологических состояниях у человека определяют с помощью рецепторного метода конкурентного связывания (табл. 335-2). Содержание витамина D и 25(OH)D в сыворотке крови меняется в зависимости от сезона года и от потребления витамина D. Однако концентрация 1,25(OH)2D в сыворотке, по-видимому, не зависит ни от сезона, ни от повышения приема витамина D с пищей, ни от воздействия солнечного света; пока поступление витамина D и концентрация 25(OH)D в крови достаточны, метаболические влияния, осуществляющиеся на уровне почечной 25(OH)D-1-гидроксилазы, обеспечивают строгую регуляцию уровня 1,25(OH)2D в крови. Содержание 1,25(OH)2D в сыворотке крови колеблется от 25 до 75 пг/мл, а период его полужизнн в сыворотке — от 3 до 6 ч.
При падении уровня кальция в сыворотке ниже нормы возрастает секреция паратиреоидного гормона, что приводит к усилению продукцию 1,25(OH)2D. Основной механизм физиологической регуляции продукции 1,25(OH)2D включает, по-видимому, изме-
Таблица 335-2. Концентрации 1,25(OH)2D. в сыворотке крови при нарушениях обмена кальция и фосфора и метаболизма костной ткани
| Патологическое состояние | Уровень, 1,25(ОН)2D в сыворотке |
| Дефицит витамина D | Понижен1 |
| Почечная недостаточность: | |
| СКФ выше 30 мл/мин на 1,7 м2 | Понижен или в пределах нормы |
| СКФ ниже 30 мл/мин на 1,7 м2 | |
| Гипопаратиреоз | То же |
| Псевдогипопаратиреоз | » » |
| Витамин D-зависимый рахит: | |
| I тип | » » |
| II тип | Повышен или в пределах нормы |
| Сцепленный с Х-хромосомон рахит, резистентный к витамину D | Понижен или в пределах нормы |
| Опухолевая остеомаляция | Понижен |
| Онкогенная гиперкальциемия | » |
| Некоторые лимфомы | Повышен |
| Гиперпаратиреоз | » |
| Саркоидоз, туберкулез, силикоз | » |
| Идиопатическая гиперкальциурия | Повышен или в пределах нормы |
| Синдром Уильямса | Повышен |
| Интоксикация витамином D | Понижен или в пределах нормы |
1 У отдельных больных с доказанной при биопсии остеомаляцией и неопределяемым или низким уровнем 25(OH)D в крови концентрация 1,25(OH)2D в сыворотке в пределах нормы или повышена. У таких больных имеется также вторичный гиперпаратиреоз, и они могут находиться в частично компенсированном состоянии; даже при поступлении с пищей или образовании в коже небольших количеств витамина D он эффективно превращается в 1,25(OH)2D. В результате на фоне низких или не поддающихся определению концентраций 25(OH)D в крови будут иметь место нормальные или повышенные концентрации 1,25(OH)2D. Однако при крайнем дефиците витамина D концентрация 1,25(OH)2D в крови низка или не поддается определению. СКФ — скорость клубочковой фильтрации.
нения уровня кальция в сыворотке, приводящие к реципрокным изменениям секреции паратиреоидного гормона, который, действуя, возможно, на концентрацию фосфора в сыворотке или тканях, контролирует скорость продукции 1,25(OH)2D. К другим факторам, повышающим продукцию 1,25(OH)2D у животных, относятся эстрогены, пролактин и гормон роста. У человека повышенная потребность в кальции в период роста, при беременности и лактации удовлетворяется путем усиления всасывания кальция в кишечнике вследствие, вероятно, увеличения активности 25(OH)D-1-гидроксилазы. В течение I и II триместров беременности содержание 1,25(OH)2D возрастает пропорционально увеличению концентрации витамин D-связывающего белка; уровень свободного 1,25(OH)2D не меняется. В течение же последнего триместра, когда происходит максимальная минерализация костей скелета плода, повышенная потребность в кальции удовлетворяется путем увеличения концентрации свободного 1,25(OH)2D, который в свою очередь усиливает всасывание кальция в кишечнике.
Патофизиология нарушений поступления витамина D с пищей и его обмена
Гиповитаминоз D развивается вследствие недостаточной эндогенной продукции витамина D3 в коже, недостаточного его поступления с пищей и/или при нарушении способности тонкого кишечника всасывать витамин D из пищевых продуктов. Патологические состояния, эквивалентные гиповитаминозу D, обусловливаются: 1) действием фармакологических средств, препятствующим осуществлению эффектов витамина D; 2) нарушением обмена витамина D или 3) дефицитом или патологией клеточных рецепторов метаболитов витамина D. Гиповитаминоз D приводит к нарушению метаболизма минеральных ионов и секреции паратиреоидного гормона, а также нарушению минерализации костей скелета (например, рахиту у детей, остеомаляции у взрослых). Изменения в костях скелета описаны в гл. 337. Что касается кальциевого обмена, то выпадение эффекта витамина D приводит к недостаточности кишечного всасывания ионов кальция и гипокальциемии. Последнее индуцирует компенсаторный вторичный гиперпаратиреоз. Повышенная секреция паратиреоидного гормона, который высвобождает кальций из костей и замедляет его клиренс в почках, направлена на смягчение гипокальциемии. (На поздних стадиях нелеченого гиповитаминоза D все же развивается тяжелая гипокальциемия.) При недостаточности витамина D, особенно на ее ранних стадиях, гипофосфатемия выступает ярче, чем гипокальциемия. При тяжелой недостаточности витамина D всасывание фосфата в кишечнике, подобно тому, что происходит с всасыванием ионов кальция, снижается. Повышенная секреция паратиреоидного гормона, хотя отчасти и ограничивает гипокальциемию, обусловливает потерю фосфата с мочой, снижая его реабсорбцию в почечных канальцах. Последний эффект мог бы играть наиболее значительную роль среди причин гипофосфатемии. При достаточной скорости клубочковой фильтрации наиболее заметными изменениями со стороны крови являются тяжелая гипофосфатемия, умеренное или небольшое снижение уровня кальция в сыворотке и повышение содержания паратиреоидного гормона. Уровень 25(OH)D в крови снижен (см. табл. 335-1), Как отмечается в гл. 337, эти нарушения в метаболизме минеральных ионов могут сопровождаться сдвигами в минерализации костей скелета.
Хотя при заболеваниях печени нарушается превращение витамина D в 25(OH)D, тесной корреляции между низким уровнем 25(OH)D в сыворотке и остеопенией нет; на метаболизм костной ткани влияют, по-видимому, множественные последствия основного заболевания. Имеется связь между длительной противосудорожной терапией и развитием остеомаляции или рахита; дефекты минерализации усугубляются у больных, получающих большое количество лекарств, и у тех, кто потребляет недостаточное количество витамина D или испытывает недостаточное солнечное освещение. Эти лекарственные средства оказывают многочисленные и сложные эффекты на кальциевый обмен. Фенобарбитал индуцирует синтез микросомальных ферментов в печени, изменяет кинетику витамин D-25-гидроксилазы и стимулирует секрецию желчи, что приводит к снижению концентрации витамина D и 25(OH)D в сыворотке крови. Как фенитоин, так и фенобарбитал влияют на обмен кальция, ингибируя его транспорт в кишечнике и мобилизацию костных минералов независимо от действия на метаболизм витамина D
Высокие дозы глюкокортикоидов вызывают нарушения кальциевого обмена и остеопороз, но остеомаляция и рахит как таковые при глюкокортикоидной терапии не развиваются. Действие глюкокортикоидов на витамин D-зависимый метаболизм кальция включает прямой ингибиторный эффект на опосредованные витамином D всасывание кальция в кишечнике и мобилизацию костных минералов, а также повышение чувствительности костных клеток к 1,25(OH)2D3 за счет либо стабилизации рецепторов 1,25(OH)2D3, либо увеличения сродства или числа этих рецепторов. У больных, длительно получающих глюкокортикоиды, концентрация 1,25(OH)2D в сыворотке может быть пониженной. Механизм (механизмы) этого явления неизвестны.
Генетический дефект печеночного 25-гидроксилирования витамина D не описан. Однако при одном из врожденных нарушений обмена кальция и метаболизма костной ткани может быть нарушена почечная продукция 1,25(OH)2D. При синдроме псевдовитамин D-дефицитного рахита (известном также под названием витамин D-зависимого рахита I типа; см. гл. 337) низкую концентрацию 1,25(OH)2D в сыворотке и нормальную терапевтическую реакцию нафизиологическиедозы 1,25(OH)2D3 (кальцитриола) (0,25—1 мкг/сут) относят за счет врожденной недостаточности почечной 25(OH)D-1-гидроксилазной активности. Кроме того, у больных со сходным фенотипом — псевдовитамин D-резистентным рахитом (витамин D-зависимым рахитом I типа) имеется, очевидно, дефицит (или нарушение) рецепторов 1,25(OH)2D, а не нарушение метаболизма витамина. У таких больных концентрация 1,25(OH)2D в сыворотке повышена; эффективность терапии высокими дозами витамина D объясняется дальнейшим увеличением концентрации 1,25(OH)2D в сыворотке.
У больных со сцепленным с Х-хромосомой гипофосфатемическим рахитом концентрация 1,25(OH)2D в сыворотке нормальна или понижена. Поскольку гипофосфатемия служит мощным стимулятором почечной 25(ОН)D-1-гидроксилазы, концентрация 1,25(OH)2D в сыворотке должна быть высокой. Поэтому даже нормальная концентрация этого соединения в сыворотке свидетельствует о функциональном нарушении в системе 25(OH)D-1-гидроксилазы. В некоторых случаях комбинация кальцитриола с фосфатными добавками обладает лучшим терапевтическим эффектом, чем сам фосфат (см. гл. 337). У больных с хронической почечной недостаточностью легкой и умеренной степени (скорость клубочковой фильтрации выше 30 мл/мин) и сниженным клиренсом фосфата гиперфосфатемия и ацидоз играют важную роль в уменьшении почечной продукции 1,25(OH)2D, несмотря на высокую концентрцию паратиреоидного гормона в крови. По мере прогрессирования деструкции коркового слоя почек резервы 25(OH)D-1-гидроксилазы истощаются так, что почки уже не в состоянии вырабатывать достаточные для поддержания кальциевого гомеостаза количества 1,25(OH)2D даже при нормальной концентрации фосфора в сыворотке. В таких условиях заместительная терапия кальцитриолом особенно эффективна (см. гл. 337).
У больных с гипопаратиреозом и псевдогипопаратиреозом содержание 1,25(OH)2D в сыворотке в среднем ниже нормы, хотя разброс индивидуальных показателей перекрывает границы нормальных колебаний. Назначение таким больным с гипокальциемией небольших заместительных доз кальцитриола (0,25—1 мкг/сут; см. гл. 336) дает положительный эффект даже в случаях более высоких, чем в норме, концентраций 25(OH)D в сыворотке. Эти данные согласуются с представлением о том, что у больных с гипопаратиреозом или псевдогипопаратиреозом из-за отсутствия паратиреоидного гормона или выпадения ею влияния нарушена функция почечной 25(OH)D-1-гидрокснлазы. Пока неясно, до какой степени можно нормализовать концентрацию 1,25(OH)2D в сыворотке путем ликвидации гипофосфатемии.
У больных с остеомаляцией, вызванной опухолью (онкогенной), содержание фосфора и 1,25(OH)2D в сыворотке снижено; предполагают, что эти опухоли секретируют вещество (или вещества), обусловливающие потерю фосфора с мочой и торможение синтеза 1,25(OH)2D. После удаления опухоли содержание фосфора и 1,25(OH)2D в сыворотке нормализуется.
При патологических состояниях, аналогичных гипервитаминозу D, таких как саркоидоз (и другие хрони ческие гранулематозные заболевания), лимфомы, идиопатическая гиперкальциурия и синдром Уильямса, нарушено превращение 25(OH)D в 1,25(OH)2D (см. табл. 335-2). Гиперкальциемия при саркоидозе связана с повышенным уровнем 1,25(OH)2D в сыворотке; саркоидные гранулемы нерегулируемо превращают 25(OH)D в 1,25(OH)2D. Последний синтезируется также макрофагами из легочных альвеол больных саркоидозом. Кроме того, даже нормальные легочные макрофаги в присутствии липополисахаридов из клеточных оболочек грамотрицательных бактерий или гамма-интсрферона начинают превращать 25(OH)D в 1,25(OH)2D. У большинства больных с опухолевой гиперкальциемией концентрации 1,25(OH)2D в сыворотке понижены (см. табл. 335-2). Исключение составляют больные с некоторыми видами лимфом (включая Т-клеточные, смешанные гистноцитарно-лимфоцитарпые и В-клеточные иммунобластные лимфомы), гиперкальциемия у которых протекает на фоне повышения концентрации 1,25(OH)2D. В одном из наблюдений после хирургического удаления солитарной лимфомы селезенки содержание 1,25(OH)2D и кальция в сыворотке быстро понизилось до нормы, что свидетельствуете нерегулируемом превращении 25(OH)D в 1,25(OH)2D клетками лимфомы. У больных с первичным гиперпаратиреозом существует прямая связь между повышенной концентрацией 1,25(OH)2D в сыворотке, гиперкальциурией и нефролитиазом. Подобно этому, всасывание кальция в кишечнике оказывается неадекватно высоким в некоторых случаях идиопатической гиперкальциурии. Примерно у 30% таких больных повышена и концентрация 1,25(OH)2D в сыворотке. Эти данные не противоречат гипотезе, согласно которой усиленное всасывание кальция в тонком кишечнике обусловлено чрезмерной продукцией 1,25(ОН)2D. У детей, страдающих гиперкальциемией и надклапанным стенозом аорты, задержкой психического развития и с «лицом эльфа» (синдром Уильямса) концентрация 1,25(OH)2D в сыворотке также повышена. Обусловлено ли это изменением синтеза или распада 1,25(OH)2D, неясно.
Фармакология витамина D и его метаболитов
Имеющиеся в продаже препараты витаминов содержат по 400 ME витамина D2 или D3. В больших дозах витамин D (кальциферол) выпускается в виде капсул и таблеток (50 000 ME), в масляном растворе (500 000 МЕ/мл) и в растворе для перорального применения (8000 МЕ/мл). После однократного приема внутрь 50 000 ME витамина D концентрация его в крови повышается через 12—24 ч с менее 10 нг/мл до 50—100 нг/мл. Период его полужизни в плазме равен примерно 2 дням. Концентрация 25(OH)D и 1,25(OH)2D не меняется. При дефиците витамина D введение его дважды в неделю по 50 000 ME в течение нескольких недель восстанавливает нормальную концентрацию 25(OH)D в сыворотке; при наличии вторичного гиперпаратиреоза содержание 1,25(OH)2D возрастает выше нормы (до 250 нг/мл). 25(OH)D, (кальцифедиол) выпускается в капсулах, содержащих 20 или 50 мкг. Это соединение может быть полезным при дефиците витамина D [низкая концентрация 25(OH)D] у больных с тяжелым нарушением функции печени. В фармакологических дозах его применяют при нарушении метаболизма 25(OH)D. Считают, что в таких дозах 25(OH)D3 оказывает эффект, взаимодействуя с рецепторами 1,25(OH)2D. 1,25(OH)2D3 (кальцитриол) выпускается в капсулах по 0,25 или 0,5 мкг. Кальцитриол эффективен при лечении различных нарушений кальциевого обмена (см. гл. 341). Сильным агонистом 1,25(OH)2D3 является также 1-гидроксивитамин D3 [1(OH)D3]. По строению этот аналог идентичен природному почечному гормону, за тем лишь исключением, что лишен ОН-группы у С25 (рис. 335-5). У человека он быстро превращается в печени в 1,25(OH)2D3. Этот аналог используют в странах Европы и в Японии.
При химических воздействиях на молекулу витамина D, приводящих к повороту кольца А на 180", С3--ОН принимает геометрическое положение, имитирующее положение С1--ОН (см. рис. 335-5). К соответствующим соединениям, называемым аналогами псевдо-1-гидроксивитамина D, относятся дигидротахистерол и 5,6-транс-витамин D3. При равных количествах (по весу) эти аналоги слабее, чем витамин D или 1,25(OH)2D3, стимулируют транспорт ионов кальция в кишечнике. Однако поскольку для приобретения активности в отношении кишечного транспорта кальция нет необходимости в их почечном 1-гидроксилировании, активность этих препаратов при патологических состояниях, оказывающих отрицательное воздействие на почечную 25(OH)D-1-гидроксилазу (гипопаратиреоз и хроническая почечная недостаточность), в 3—10 раз превышает активность витамина D. В печени эти аналоги быстро превращаются в соответствующие 25-гидроксипроизводныс, которые и представляют собой биологически активные формы.
Паратиреоидный гормон
Физиология. Функция паратиреоидного гормона заключается в поддержании концентрации кальция во внеклеточной жидкости. Он действует непосредственно на кости и почки и опосредованно — на кишечник, влияя на синтез 1,25(OH)2D3, что повышает уровень кальция в сыворотке. Продукция паратиреоидного гормона строго регулируется концентрацией ионизированного кальция в сыворотке. Эта система обратной связи — один из важнейших гемостатических механизмов, жестко регулирующих уровень кальция во внеклеточной жидкости. Любой тенденции к гипокальциемии, которая могла бы возникнуть при недостаточном содержании кальция в диете, противодействует повышение скорости секреции паратиреоидного гормона. В результате: 1) возрастает скорость растворения минерального вещества кости, что приводит к увеличению поступления кальция из костей в кровь; 2) снижается почечный клиренс кальция, что способствует возвращению во внеклеточную жидкость большего количества фильтруемого в клубочках кальция; 3) увеличивается всасывание кальция в кишечнике. Физиологическое значение трех этих эффектов паратиреоидного гормона — стимуляции транспорта кальция в костях, почках и кишечнике — неясно. Большинство данных свидетельствует о том, что быстрые изменения уровня кальция в крови определяются действием гормона на кости и в меньшей степени — на почечный клиренс кальция. С другой стороны, длительное поддержание кальциевого баланса определяется, по-видимому, влиянием гормона на уровень 1,25(OH)2D3 и, следовательно, на эффективность всасывания кальция в кишечнике. Изучение кинетики кальция показывает, что ежесуточно между внеклеточной жидкостью и костью перемещается до 500 мг кальция (огромное количество, если учесть общее содержание кальция во внеклеточной жидкости), причем главным регулятором этого перемещения служит паратиреоидный гормон. Действие последнего направлено на быстрое восстановление концентрации кальция

Рис. 335-5. При обработке витамина D йодом (I2) или восстановлением Н2 кольцо А молекулы витамина поворачивается на 180°, что приводит к пространственной переориентации 3-ОН-группы в псевдо-1-ОН-положение. Такие соединения, 5,6-трансвитамин D3 и дигидротахистерол (ДГТ,), называют псевдо-1-гидроксианалогами витамина D. 1(OH)D3 представляет собой синтетический аналог 1,25(OH)2D3, лишенный С25ОН. Все эти соединения — 1(OH)D3, 5,6-трансвитамин D3 и ДГТ3 — в печени подвергаются С25-гидроксилированию и лишь после этого приобретают биологическую активность.
в крови ценой деструкции кости и высвобождения минералов. Однако большое значение в быстрой регуляции уровня кальция в крови может иметь и влияние паратиреоидного гормона на почки, направленное на сохранение кальция путем усиления реабсорбции фильтруемого иона.
Паратиреоидный гормон оказывает на кости двоякое действие; под его влиянием происходят замещение кальция и реконструкция кости. Скорость выхода кальция из кости в кровь возрастает уже через несколько минут после введения паратиреоидного гормона, но высвобождению кальция предшествует быстрый отток его из крови, по-видимому, в костные клетки. С другой стороны, более длительное влияние паратиреоидного гормона, сводящееся главным образом к увеличению числа и активности остеокластов и общему ускорению реконструкции кости, проявляется лишь через несколько часов после его введения. Помимо действия на костную ткань, паратиреоидный гормон вызывает повышение синтеза белка, сохраняющееся в течение нескольких часов после введения гормона. Пока неясно, отражают ли две группы эффектов паратиреоидного гормона непрерывную последовательность его действия с общим начальным биохимическим механизмом или они не зависят друг от друга. Принято считать, что рецепторами паратиреоидного гормона обладают только остеобласты, но не остеокласты.
Химия. Расшифрованы полные аминокислотные последовательности основных форм
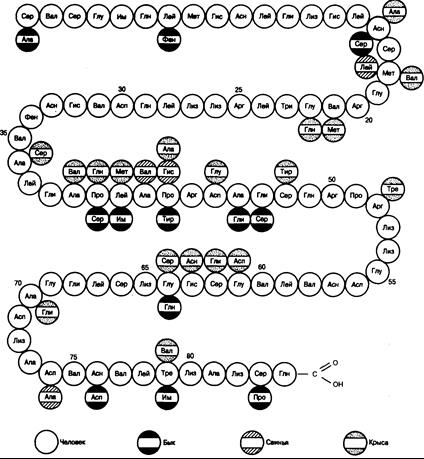
Рис. 335-6. Схема, иллюстрирующая аминокислотную последовательность паратиреоидного гормона человека, быка, крысы и свиньи.
паратиреоидного гормона крупного рогатого скота, свиньи, крысы и человека. Все эти пептиды представляют собой одноцепочечную структуру, состоящую из 84 аминокислотных остатков. Молекула гормона лишена цистеина или цистина. Как показано на рис. 335-6, три вида гормона имеют сходные последовательности.
Определены те структурные особенности, которые необходимы для связывания гормона с рецепторами и, следовательно, его биологической активности. Синтетические фрагменты, содержащие аминоконцевую последовательность, воcпроизводят известные влияния гормона на транспорт ионов кальция в почках и костях, а также (путем стимуляции почечной 25-гидроксивитамин D-1-гидроксилазы) на всасывании кальция в кишечнике. Поскольку рецепторами паратиреоидного гормона обладают остеобласты и фибробласты, но не остеокласты, стимуляция этим гормоном резорбции кости остеокластами — эффект непрямой.
Укорочение фрагментов с аминоконца вначале приводит к потере способности вызывать биологическую реакцию, а затем уже сродства к рецепторам. Пептид 7—34 является конкурентным ингибитором как связывания активного гормона с рецепторами in vitro, так и реакции почек на гормон, в том числе повышения экскреции циклического АМФ и клиренса фосфата. В некоторых тест-системах in vivo блокируется и быстрая мобилизация кальция из костей.
Любой фрагмент паратиреоидного гормона, чтобы оказать биологическое действие на кости и почки, должен содержать непрерывную пептидную последовательность, начиная со 2-го остатка — валина и до 26-го остатка — лизина.
Эти данные представляют особый интерес в связи со сложностью биосинтеза и периферического метаболизма паратиреоидного гормона.
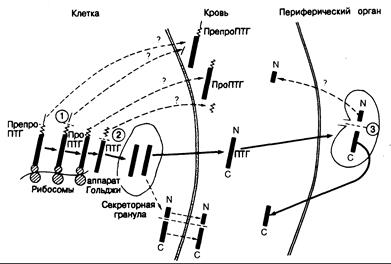
Рис. 335-7. Схематическое изображение биосинтеза, секреции и периферического метаболизма паратиреоидного гормона, а также значения этих процессов для гетерогенности иммунореактивного паратиреоидного гормона в крови (см. текст).
Биосинтез включает начальную трансляцию специфической информационной РНК (иРНК) паратиреоидного гормона в полипептид, состоящий из 115 аминокислот — препропаратиреоидный гормон (пре-проПТГ), вслед за чем происходят специфические посттрансляционные расщепления. Первое расщепление (1) осуществляется уже в первые секунды синтеза в эндоплазматическом ретикулуме или вблизи него; при этом удаляется 25-членный специфический для препроПТГ пептид, или лидерная последовательность (показана тонкой прямой линией). На продукт, проПТГ, состоящий из 90 аминокислот, действует вторая специфическая пептидаза (пептидазы), которая удаляет еще один специфический пептид (показанный ломаной линией) с образованием ПТГ. (Возможен и другой путь — проПТГ превращается в ПТГ после упаковки в секреторные гранулы.) ПТГ, состоящий из 84 аминокислотных остатков [показанный жирной линией с М-(амино) и С-(карбокси) концами] — главный продукт клеточной секреции, происходящей путем экзоцитоза содержащих гормон секреторных гранул (показано жирной стрелкой). Имеются некоторые сообщения, согласно которым существует и альтернативный путь секреции: аминоконцевые (N-) и карбоксиконцевые (С-) фрагменты молекулы образуются в ходе дальнейшего протеолитического процессинга в клетке с последующим выходом их в кровь (пунктирные стрелки). Предположения (пока не доказанные), касающиеся выхода из клетки в кровь предшественников или фрагментов, показаны пунктирными стрелками с вопросительным знаком. Периферический метаболизм включает поглощение интактного гормона некоторыми органами (наиболее вероятно, печенью и почками), где происходит третье расщепление (3). Считают, что это последнее расщепление приводит к образованию аминоконцевого (N-) и карбоксиконцевого (С-) фрагментов. Карбоксиконцевои фрагмент возвращается в кровь, откуда он элиминируется медленнее, чем интактный гормон. Поэтому концентрация карбоксиконцевого фрагмента выше, чем интактного ПТГ. Судьба аминоконцевого фрагмента, предположительно образующегося в процессе периферического метаболизма, остается неизвестной. Требует выяснения также вопрос об относительном значении периферического метаболизма и непосредственного высвобождения фрагментов из железы для гетерогенности паратиреоидного гормона в крови.
Биосинтез, секреция, метаболизм и механизм действия. На пути от транскрипции генов и трансляции до окончательной упаковки 84-членного пептида в предназначенные к секреции гранулы идентифицирован ряд более крупных молекулярных форм гормона (рис. 335-7). Самая ранняя из прекурсорных форм, называемая препропаратиреоидным гормоном, состоит из 115 аминокислотных остатков; эта молекулярная форма превращается в промежуточную форму из 90 аминокислотных остатков, называемую пропаратиреоидным гормоном. Подробности внутриклеточной регуляции биосинтеза неизвестны. Такой сложный путь от первоначального синтеза в виде более крупной молекулы, которая затем еще до секреции уменьшается в размерах в результате нескольких расщеплений, свойствен не только паратиреоидному гормону, но и другим полипептидам и белкам, предназначенным к секреции из клеток. Гидрофобные участки препропаратиреоидного гормона сходны с преучастками других секретируемых клетками белков и могут играть роль посредников, направляющих их транспорт от мест синтеза на полирибосомах через цитоскелет в секреторные гранулы. Гены бычьего, крысиного и человеческого паратиреоидного гормона клонированы, и их структуры расшифрованы. В структурах генов разных видов, равно как и в кодируемых ими белках, имеется высокая степень гомологии.
Секреция паратиреоидного гормона контролируется концентрацией ионов кальция в крови, а именно фракцией ионизированного кальция. При снижении концентрации кальция с нормальной до 75—80 мг/л (по данным определения общего кальция) скорость секреции гормона постепенно возрастает до максимальной, которая в 5 раз превышает исходную. Секреция гормона возрастает под влиянием -адренергических агонистов и агонистов рецепторов-2 гистамина, но физиологическое значение этих стимуляторов не установлено. Больше того, такие средства, как пропранолол или циметидин, не всегда снижают уровень паратиреоидного гормона в сыворотке.
Магний может изменять секрецию в том же направлении, что и кальций. Хотя физиологические колебания концентрации магния вряд ли отражаются на секреции околощитовидных желез, резкий дефицит внутриклеточного магния нарушает секрецию гормона.
Гормон, секретируемый in vivo нормальными околощитовидными железами быка и человека и паратиреоидными аденомами, не отличается по иммунологическим критериям и размерам молекулы от 84-членного пептида (мол. масса 9500), экстрагируемого из желез. Однако большая часть иммунореактивного материала, обнаруживаемого в периферической крови человека и животных (бык, свинья), имеет меньшие размеры, чем экстрагируемый или секретируемый гормон. Основные циркулирующие фрагменты иммунореактивного гормона (мол. масса приблизительно 7000) лишены важнейшей аминоконцевой последовательности, определяющей биологическую активность, и, следовательно, представляют собой биологически неактивные фрагменты гормона.
Расщепление нативного пептида эндопептидазой должно было бы приводить к появлению и второго фрагмента с мол. массой 2000—3000, который соответствует аминоконцевой биологически активной части гормона. Однако присутствие в крови такого аминоконцевого фрагмента не доказано. Неясно также, что определяет появление в крови фрагмента (фрагментов) гормона — периферический его метаболизм или непосредственная секреция (как и интактного гормона) железой, и является ли периферический метаболизм только катаболическим процессом, ведущим к разрушению гормона, или он приводит к образованию активного аминоконцевого фрагмента паратиреоидного гормона. Последние данные указывают на то, что основными местами периферического метаболизма гормона служат печень и почки. Расщепление его в этих органах могло бы регулировать концентрацию гормонально-активных полипептидов в крови (см. рис. 335-7). В свою очередь на периферический метаболизм могли бы влиять такие патологические процессы, как почечная недостаточность или тяжелая дисфункция печени.
Скорость клиренса секретируемого 84-членного пептида в крови превышает таковую меньшего биологически неактивного фрагмента (фрагментов), образующихся в результате периферического метаболизма. Следовательно, результаты определения уровня паратиреоидного гормона в крови с помощью большинства иммунологических методов дают лишь приблизительное представление об активности околощитовидных желез, а не прямую оценку количества биологически активного гормона, поскольку основную циркулирующую форму иммунореактивного гормона составляют именно биологически инертные фрагменты, а не интактный гормон. Изменение скорости продукции пли клиренса фрагментов может сказываться на концентрации иммунореактивного гормона даже в отсутствие сдвигов в скорости гормональной секреции. Такое расхождение между концентрациями иммунореактивного и биологически активного гормона встречается, например, при почечной недостаточности, так как почки, по-видимому, играют основную роль в экскреции гормональных фрагментов из организма.
Биохимическое действие паратиреоидного гормона включает его влияние на аденилатциклазу клеток-мишеней. Стимуляция активности этого фермента при специфическом взаимодействии гормона с мембраной клетки-мишени приводит к повышению внутриклеточного уровня циклического АМФ (см. также гл. 67). Паратиреоидный гормон взаимодействует с комплексом специфический рецептор — аденилатциклаза на плазматической мембране клетки. Этот комплекс состоит из гормонального рецептора, каталитической ферментной единицы (аденилатциклазы) и регуляторного белка (G- или N-белок), связывающего гуаниловые нуклеотиды (ГТФ или ГДФ) (см. гл. 67). Этот последний белок состоит из -субъединиц, связывающих ГТФ или ГДФ, и -субъединиц, которые диссоциируют отбелка, когда -субъединицы связывают ГТФ и вновь присоединяются к белку, когда -субъединицы связывают ГДФ. Будучи связанной с ГТФ, -субъединицакомплексируется с аденилатциклазой, что приводит к активации последней и увеличению скорости образования циклического АМФ из АТФ. Гидролиз ГТФ до ГДФ на -субъединице обусловливает реассоциацию субъединиц G-белка и снижение активности аденилатциклазы. Коротко говоря, связывание гормона с рецептором запускает цикл связывания ГТФ -субъединицей и активирует фермент.
После введения паратиреоидного гормона повышение уровня циклического АМФ в моче предшествует сколько-нибудь заметному увеличению экскреции фосфата. Подобно этому, действие на активность аденилатциклазы кости можно обнаружить уже в течение первой минуты после добавления паратиреоидного гормона к суспензии костных клеток. Кроме того, введение дибутирил-циклического АМФ имитирует действие паратиреоидного гормона у паратиреоидэктомированных животных. Дибутирил-циклический АМФ вызывает повышение уровня кальция в сыворотке, снижение содержания в ней фосфата и увеличение экскреции кальция, фосфата и гидроксипролина с мочой.
Механизм, посредством которого повышенная внутриклеточная концентрация циклического АМФ обусловливает сдвиги в транслокации ионов кальция и фосфата, неизвестен. В отдельных чувствительных к гормону тканях, где гормон действует через механизм циклического АМФ, обнаружена стимуляция протеинкиназ, которые в свою очередь обеспечивают фосфорилирование белков, инициирующих гормональный эффект.
Каков бы ни был этот механизм, но первый физиологический эффект (возникающий в течение нескольких минут) паратиреоидного гормона — это гипокальциемия, связанная с оттоком кальция из крови в клетки (по всей вероятности, костные). Таким образом, «вторым посредником» действия паратиреоидного гормона в клетках-мишенях может быть как циклический АМФ, так и кальций.
Патофизиология. При гиперпаратиреозе наблюдается чрезмерная продукция паратиреоидного гормона опухолями околощитовидной железы или гиперплазированными железами, причем гиперплазия затрагивает все железы. Избыток гормона приводит к гиперкальциемии вследствие ускорения всасывания кальция в кишечнике [повышение синтеза 1,25(OH),DJ и снижения почечного клиренса кальция. У большинства больных возрастает также резорбция костной ткани; кругооборот компонентов кости увеличивается у всех больных, но у многих из них процессы резорбции преобладают над процессами образования кости. Реакции отдельных тканей-мишеней (кишечник, почки и кости) на избыток гормона у больных обнаруживают индивидуальные колебания; факторы, обусловливающие различие этих реакций у разных больных, остаются неизвестными (см. гл. 336).
В результате влияния избыточных количеств паратиреоидного гормона па реабсорбцию фосфата в почечных канальцах возникает гипофосфатемия, которая в свою очередь усиливает гиперкальциемию отчасти за счет повышения как синтеза 1,25(ОН)2D3, так и чувствительности кости к резорбции. Гипофосфатемия может также препятствовать нормальной минерализации кости, что создает смешанную картину повышенной резорбции и недостаточной минерализации на соседних участках костей скелета.
Гипопаратиреоз сопровождается гипокальциемией и гиперфосфатемией, т. е. сдвигами, обратными тем, которые наблюдаются при избытке гормона (см. гл. 336).
Кальцитонин (см. гл. 334)
Кальцитонин —это пептидный гормон, обладающий мощным гипокалиемическим и гипофосфатемическим действием, который во многих отношениях выступает в роли физиологического антагониста паратиреоидного гормона. Кальцитонин уменьшает резорбцию костей и влияет на почки противоположным по сравнению к паратиреоидным гормоном образом, т. е. увеличивает клиренс кальция. Эффекты кальцитонина опосредуются стимуляцией связанной с мембранами аденилатциклазы в разных клетках почек и костей, обладающих рецепторами к этому гормону. Чувствительность разных клеток почечных канальцев к кальцитонину, паратиреоидному гормону и вазопрессину неодинакова. В некоторых сегментах нефрона клетки реагируют на все три гормона, но в других — только на один или два из них. Среди костных клеток рецепторами кальцитонина обладают остеокласты.
У млекопитающих основным источником гормона служит щитовидная железа, а клетки, синтезирующие кальцитонин, происходят из ткани нервного гребешка. Во время эмбриогенеза эти клетки мигрируют в ультимобрахиальное тельце, которое образуется из последнего брахиального мешка, почему и называется ультимобрахиальным. У низших позвоночных ультимобрахиальное тельце остается отдельным органом, анатомически несвязанным со щитовидной железой. У млекопитающих же это тельце или железа, сливается со щитовидной железой и включается в нее. Кальцитонин обнаружен у позвоночных всех классов.
Природные кальцитонины состоят из пептидной цепи, насчитывающей 32 аминокислотных остатка. Аминокислотные последовательности в гормонах разных видов существенно различаются. В организме для проявления биологической активности необходима, по-видимому, вся 32-членная цепь, хотя в системах in vitro функционируют и фрагменты гормона. Факторы, регулирующие синтез кальцитонина, неизвестны. В равных по весу количествах кальцитонин лосося в 25—100 раз сильнее снижает уровень кальция в сыворотке млекопитающих, чем другие формы этого гормона. Например, у человека лососевый гормон по крайней мере в 10 раз активнее человеческого кальцитонина. Большая биологическая активность кальцитонина лосося отчасти может объясняться его медленным клиренсом, но он и более прочно связывается с рецепторами. Кальцитонин синтезируется в виде молекулы-предшественника, которая в 4 раза больше самого гормона. При анализе последовательности кодирующих участков гена кальцитонина крысы обнаружили по крайней мере два соседних с кальцитонином пептида, которые отделяются от гормона основными остатками. По аналогии с общим предшественником для АКТГ и эндорфина можно думать, что эти пептиды секретируются вместе с кальцитонином и оказывают эффекты, которые могли бы объяснить, например, некоторые патофизиологические особенности синдромов, обусловленных избыточной продукцией кальцитонина. Имеются два гена кальцитонина — и , расположенные на 11-й хромосоме в общей области генов бета-глобина и паратиреоидного гормона. Транскрипция гена кальцитонина — сложный процесс. С -гена транскрибируются две разные информационные РНК; одна транслируется в предшественник кальцитонина, а другая — в особый продукт: пептид, связанный с геном кальцитонина (ПСГК). Синтез ПСГК сопровождает любую экспрессию мРНК кальцитонина, например, при медуллярном раке щитовидной железы. Ген транскрибируется в информационную РНК ПСГК в центральной нервной системе млекопитающих, где ПСГК может выполнять роль нейротрансмиттера. У человека в отличие от животных экспрессия -гена не обнаружена, но предположительно существует.
Секреция кальцитонина находится под непосредственным контролем уровня кальция в крови: при увеличении содержания кальция концентрация кальцитонина повышается, а при падении снижается. Попав в кровь, кальцитонин быстро исчезает из нее, период его полужизни 2—15 мин.
Концентрация кальцитонина в периферической крови здоровых людей ниже, чем у животных многих видов. Базальный и стимулированный уровни иммунореактивного кальцитонина у женщин ниже, чем у мужчин, а тенденция к снижению этих уровней с возрастом у женщин выражена в большей степени.
Физиологическая роль кальцитонина не совсем понятна. У животных кальцитонин снижает содержание в крови как кальция, так и фосфата; в основе этого действия лежит торможение резорбции костной ткани. Увеличение клиренса кальция и фосфора с мочой под действием кальцитонина лишь усиливает проявления его влияния на резорбцию костей. В свою очередь регуляция продукции кальцитонина кальцием сыворотки крови модулирует действие гормона на почки и кость. Таким образом, представление о роли кальцитонина в защите от гиперкальциемии основано на гипокальциемических его эффектах, реализующихся в ответ на гиперкальциемию.
Однако у здоровых взрослых людей роль кальцитонина остается неясной. У человека даже крайние колебания продукции гормона не сопровождаются заметными сдвигами в метаболизме кальция и фосфата. Нет также определенных симптомов, которые можно было бы отнести за счет недостаточности (у тиреоидэктомированных больных, получающих заместительную терапию только тироксином) или избытка (у больных с секретирующей кальцитонин опухолью — медуллярным раком щитовидной железы) кальцитонина. При последнем заболевании больные страдают от множества тяжелейших последствий злокачественного роста (см. гл. 334), но кальциевый или костный метаболизм у них не нарушается, вероятно, потому, что они приобретают резистентность к влиянию кальцитонина на кости скелета.
Поэтому в настоящее время интерес врачей сосредоточен на применении кальцитонина в качестве терапевтического средства или использовании результатов его радиоиммунологического определения для выявления медуллярного рака (см. гл. 334). Кальцитонин с успехом применяют для лечения больных с костной болезнью Педжета.
Дата добавления: 2015-07-22; просмотров: 1264;
