ГЛАВА 335. ОБМЕН КАЛЬЦИЯ, ФОСФОРА И КОСТНАЯ ТКАНЬ: КАЛЬЦИЙРЕГУЛИРУЮЩИЕ ГОРМОНЫ
Майкл Ф. Холик, Стефеп М. Крепи, Джои Т. Поттс, младший (Michael F. Holick, Stephen M. Krone, John T. Potts, Jr.)
Структура и метаболизм костной ткани (см. гл. 337)
Кость — это динамическая ткань, постоянно перестраивающаяся на протяжении жизни человека. Кости скелета хорошо васкуляризованы и получают примерно 10% минутного объема крови. Строение плотной и губчатой костей создает оптимальное для движений сочетание силы и прочности. Кроме того, кость обеспечивает организм кальцием, магнием, фосфором, натрием и другими ионами, необходимыми для поддержания гомеостатических функций организма.
Свойства кости определяются ее внеклеточным веществом. Кость включает твердый минеральный компонент, тесно связанный с органическим матриксом, который на 90— 95% состоит из коллагена I типа (см. гл. 319). Неколлагеновая часть органического матрикса представлена белками сывороточного происхождения (альбумин и 2-НS-гликопротеиды), белком, содержащим -карбоксиглутаминовую кислоту (который называют костным ГЛА -белком, или остеокальцином), гликопротеидом, называемым остеонектином, а также костным протеигликаном и другими гликопротеидами, фосфопротеидами и сиалопротеидами. Функция некоторых из этих белков может заключаться в инициации минерализации и связывании минеральной фазы с матриксом. Минеральная фаза костной ткани представлена кальцием и фосфатом [эмпирическая формула Са10(РО4)6(ОН)2]. Кроме того, в кости присутствуют и другие ионы, преимущественно в поверхностных слоях. Минеральная фаза тесно контактирует с коллагеновыми волокнами и локализуется главным образом в специфических участках внутри «ячеек», образуемых этими волокнами. Такая структурная организация минеральной фазы и матрикса формирует двухфазное вещество, точно соответствующее задаче противостояния механическим нагрузкам. Образование и локализация неорганической фазы, по-видимому, частично определяются органическим матриксом.
Кость формируют клетки мезенхимального происхождения, которые синтезируют н секретируют органический матрикс. Минерализация матрикса, особенно в остеонах (гаверсовы системы), начинается вскоре после его секреции клетками (первичная минерализация), а заканчивается лишь через несколько недель (вторичная минерализация). Поскольку подвергаемый минерализации матрикс секретируется остеобластами, эти клетки окружаются им и превращаются в остеоциты, снабжаемые кровью через ряд канальцев. Резорбцию кости осуществляют в основном остеокласты. Это многоядерные клетки, образующиеся в результате слияния клеток-предшественников, которые в свою очередь дифференцируются из гемопоэтической стволовой клетки, дающей начало мононуклеарным фагоцитам. Резорбция кости происходит в фестончатых пространствах (лакуны Хаушипа), где остеокласты прикрепляются к костному матриксу через кольцо сократительных белков (прозрачная зона) и образуют своеобразную гофрированную каемку. Там, где каемка формирует складки и контактирует с костью, последняя теряет как минеральный компонент, так н матрикс. В мембране гофрированной каемки присутствует
АТФаза протонового насоса, создающая особую кислую среду в ограниченном внеклеточном пространстве, что приводит к солюбилизации минеральной фазы. Остеобласты участвуют в синтезе и секреции основной массы органического матрикса и регулируют его минерализацию. Щелочная фосфатаза кости локализуется в остеобластах. Активное соединение, которое в конце концов обеспечивает формирование кости, называется костным морфогенетическим белком. Рост и/или синтез матрикса остеобластами стимулируется дополнительными факторами (ряд ростовых факторов костного происхождения, соматомедины, трансформирующий фактор роста).
У эмбриона и растущего ребенка кости формируются либо путем реконструкции и замещения ранее кальцифицированного хряща (эндохондральное формирование кости), либо без хрящевого матрикса (внутримембранное формирование кости). В новой кости, будь то у эмбриона или ребенка, или в случае заживления переломов у взрослых отношение клеток к матриксу довольно велико. Костная ткань характеризуется присутствием переплетающихся и редко расположенных грубых пучков коллагеновых волокон (гладкая кость). У взрослых образуется более зрелая кость, в которой пучки волокон расположены упорядочение параллельными линиями или концентрическими кругами (пластинчатая кость). В длинных костях пластинки уложены концентрически вокруг кровеносных сосудов и образуют гаверсовы системы. В длину кость растет в результате пролиферации хрящевых клеток и эндохондральной последовательности в ростовой пластинке. Рост в ширину и утолщение осуществляются вследствие формирования кости на периостальной поверхности и резорбции поверхности эндоста, причем скорость формирования должна превышать скорость резорбции. У взрослых после закрытия эпифизов рост кости в длину и эндохондральное ее формирование прекращаются, если не считать некоторой активности хрящевых клеток суставных поверхностей. Однако даже у взрослых лиц реконструкция кости (как гаверсовых систем, так и трабекулярной кости) происходит в течение всей жизни, в чем можно убедиться, регистрируя включение радиоизотопов или флюоресценцию тетрациклинов, фиксирующихся в участках свежей минерализации кости. С помощью количественных гистоморфометрических методов показано, что новообразуемые поверхности гладкие, характеризуются способностью поглощать тетрациклин и относительно низкой плотностью минерального компонента. Формирующиеся поверхности покрыты активными остеобластами. Толщина слоя, образующегося из-за относительного отставания минерализации нового органического матрикса, в норме не превышает примерно 12 мкм. О скорости формирования кости можно судить по результатам исследования недеминерализованных срезов костных биоптатов от лиц, получавших тетрациклин с некоторым интервалом. На срезах расстояние между флюоресцирующими слоями соответствует новообразованной кости. Участки резорбции неровной конфигурации и содержат остеокласты (рис. 335-1). Резорбция предшествует образованию и протекает более интенсивно, но короче по времени, чем образование кости. У взрослых лиц в процесс активной резорбции вовлекается примерно 4% поверхности трабекулярной кости (такой как гребень подвздошной кости), а остеоид покрывает 10—15% поверхности этой кости. Кинетические исследования с помощью радиоактивного кальция (47Са) показали, что в скелете ежегодно обменивается до 18% общего содержания кальция. Таким образом, кость — это ткань с активным метаболизмом, и целостность ее клеток зависит от интактности кровоснабжения. Реконструкция кости каким-то образом связана с постоянными механическими нагрузками на нее. Кость служит также резервуаром минеральных ионов, особенно кальция, необходимых для различных физиологических процессов.
Реакция кости на переломы, инфекции, прекращение кровоснабжения, а также на другие патологические процессы сравнительно ограничена. Мертвая кость резорбируется, а новая формируется, что сопровождается врастанием новых кровеносных сосудов в пораженную область. При повреждениях, нарушающих целостность ткани, например при переломах с расхождением и смещением концов, остеопрогениторные клетки стромы дифференцируются в клетки с иными функциональными свойствами, чем у остеобластов, и заживление сопровождается образованием фиброзной ткани и хряща. При правильной фиксации отломков и малой подвижности в месте перелома заживление происходит преимущественно путем формирования новой кости без образования рубцовой ткани. Реконструкция этой кости совершается вдоль силовых линий, определяемых механическими нагрузками, которые каким-то образом транслируются в биологическую реакцию.
При прогрессирующих процессах, например при опухолях, на поверхности кости, контактирующей с опухолью, возникает резорбция. Изгиб усиливает новообразование кости на вогнутой поверхности с резорбцией на выпуклой, что, очевидно, направлено на формирование наиболее прочной механической структуры. Даже при столь разрушительных процессах, как болезнь Педжета, реконструкция кости определяется механическими силами. Таким образом, пластичность кости обусловливается реакцией клеток, взаимодействующих друг с другом и с окружающей средой.
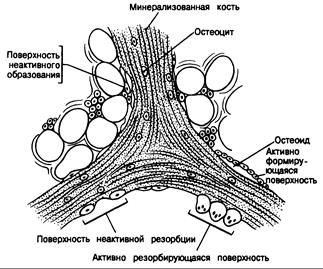
Рис. 335-1. Схематическое изображение реконструирующихся поверхностей трабекулярной кости.
Большая часть костной поверхности у взрослых не подвергается ни новообразованию, ни резорбции. Такие участки обычно гладкие, лишены остеоидного слоя и покрыты либо невидимыми, либо уплощенными клетками. Поверхности активного новообразования — гладкие и покрыты остеобластами, формирующими остеоидный слой (прозрачный) толщиной не более 12 мкм. Фронт кальцификации проходит по местам контакта остеоидного слоя и минерализованной кости (затемнена). Поверхности неактивного костеобразования не покрыты остеобластами и на них присутствует лишь немного уплощенных клеток. Поверхности активной резорбции — неровные или бахромчатые и покрыты многоядерными остеокластами. На поверхностях с неактивной резорбцией последние не видны.
Механизмы формирования и резорбции кости. Образование кости — это упорядоченный процесс, при котором неорганические вещества откладываются в органический матрикс. Минеральная фаза состоит из кальция и фосфора, и на скорость ее образования влияют концентрации этих ионов в плазме и внеклеточной жидкости. Если концентрация кальция и фосфора сходна с таковой в ультрафильтрате плазмы, минерализация и рост кристаллов гидроксиапатита могут происходить in vitro. Однако концентрация этих ионов в участках минерализации неизвестна, и локальную концентрацию кальция, фосфора и других ионов каким-то образом регулируют клетки (остеобласты, остеоциты). Коллагены из разных источников катализируют формирование очагов выпадения кальция и фосфора из рас 1 воров этих ионов, и вначале минеральная фаза откладывается в специфических участках ячеек, образованных особо упакованными молекулами коллагена. Организация коллагена, вероятно, влияет на количество и характер минеральной фазы кости. Существует по одному гену для каждой из двух 1-цепей и одной 2-цепи, из которых построен коллаген I типа. Первичная структура коллагена I типа в коже и костной ткани сходна. Однако имеются различия в посттрансляционных модификациях коллагена I типа, таких как гидроксилирование, гликозилирование, а также в характере, числе и распределении межмолекулярных поперечных связей. Кроме того, нормально минерализованный коллаген кости и дентина обладает более крупными ячейками, чем неминерализованные коллагены, например, в сухожилиях. Неколлагеновые органические компоненты, такие как костной ГЛА-белок или остеонектин, также могут принимать участие в формировании минеральной фазы кости. Щелочная фосфатаза—это маркер остеобластов, и ее уровень в клетках коррелирует с их потенциалом минерализации. Хотя у лиц со сниженным уровнем щелочной фосфатазы (гипофосфатазия) отмечаются нарушения минерализации, функция этого фермента в процессе минерализации остается не совсем понятной. Для объяснения способности коллагена неминерализованных тканей катализировать образование очагов неорганической фазы из растворов, сходных по составу с нормальной внеклеточной жидкостью, привлекают предположение о регуляции минерализации ингибиторами этого процесса. Неорганический пирофосфат в концентрациях, ниже необходимых для связывания ионов кальция, оказывается мощным ингибитором минерализации. Поскольку щелочная фосфатаза, присутствующая в остеобластах и других клетках, при нейтральном рН способна катализировать гидролиз неорганического пирофосфата, этот фермент мог бы регулировать минерализацию, меняя концентрации пирофосфата. Кроме того, на скорость и степень минерализации могут влиять и макромолекулярные ингибиторы, такие как агрегаты протеогликанов. В подвергающемся кальцификации хряще вне клеток присутствуют связанные с мембраной пузырьки, содержащие минеральные вещества, и предполагается, что это и есть начальная минеральная фаза.
В кости твердая фаза. фосфата кальция в начале минерализации представлена СаНРО4•2Н2О. По мере минерализации твердая фаза превращается в плохо кристаллизованный гидроксиапатит с относительно низким (около 1,2) молярным отношением кальций/фосфор. С возрастом и созреванием степень кристаллизации и отношение кальций/ фосфор увеличиваются. Если в минеральную фазу включаются ионы фтора, то доля аморфного фосфата кальция снижается, а кристаллизация его увеличивается.
Существует предел концентрации ионов кальция и фосфора во внеклеточной жидкости, ниже которого минерализация не возникает. «Произведение растворимости» для минерального вещества кости рассчитать трудно, так как состав минеральной фазы непостоянен и природа присутствующих в растворе веществ, определяющих это произведение растворимости, неизвестна. Тем не менее при чрезмерной концентрации кальция и фосфора во внеклеточной жидкости минеральная фаза может появиться и там, где в норме ее не бывает.
При резорбции кости ионы кальция и фосфора из твердой фазы переходят во внеклеточную жидкость, а потом уже рассасывается органический матрикс. Как протекают эти процессы, не совсем ясно. Выход минеральных веществ из кости можно было бы объяснить снижением рН, наличием хелирующего агента и функционированием механизма клеточного насоса, сдвигающего равновесие между твердой фазой и раствором. Тот факт, что резорбция кости происходит в участках прилегания к ее поверхности остеокластов, где рН внеклеточной жидкости имеет низкую величину, подтверждает предположение о том, что для солюбилизации минералов кости необходима кислая среда. Хотя остеокласты богаты резистентной к тартрату кислой фосфатазой, конкретная функция этого фермента неизвестна. Если при увеличении числа или усилении функции остеобластов активность сывороточной щелочной фосфатазы повышается, то для кислой фосфатазы подобные сдвиги отсутствуют. Матрикс резорбируется под действием протеиназ, высвобождаемых остеокластами. Однако пока не будет удалена минеральная фаза, белки костного матрикса не могут быть разрушены. На скорость резорбции кости влияют такие гормоны, как паратиреоидный гормон и 1,25(ОН)2 — витамин D, а также местные факторы, например простагландины, гепарин из тучных клеток и различные цитокины, которые либо повышают активность уже имеющихся остеокластов, либо ускоряют их дифференцировку из гематопоэтических предшественников. Некоторые из этих факторов влияют непосредственно на остеокласты, тогда как прочие действуют опосредованно через другие клетки, такие как остеобласты или фибробласты стромы. Например, рецепторы паратиреоидного гормона присутствуют на остеобластах, но не на остеокластах; следовательно, ускорение резорбции кости под действием паратиреоидного гормона опосредуется остеобластами.
Интерлейкин-1 (монокин, повышающий резорбцию кости in vitro) активирует остеокласты также опосредованно, действуя через остеобласты или фибробласты стромы. В-и Т-лимфоциты могут продуцировать и другие аналогичные факторы. Ускоряющий резорбцию эффект таких лигандов, как трансформирующий фактор роста, в некоторых костях обусловливается стимуляцией синтеза и высвобождения простагландинов. С другой стороны, главный ингибитор костной резорбции кальцитонин действует прямо на рецепторы остеокластов. На какие клетки влияют другие ингибиторы резорбции кости, такие как гамма-интерферон, пока неизвестно.
Метаболизм кальция
В организме взрослого человека содержится в среднем около 1—2 кг кальция, из которых более 98% приходится на кости скелета. Кальций минеральной фазы на поверхности кристаллов находится в равновесии с ионами внеклеточной жидкости, но лишь небольшая часть общего кальция (примерно 0,5%) подвергается обмену. Кальций, находящийся во внеклеточной жидкости, необходим для многих функций организма, и его содержание здесь весьма стабильно. У здорового взрослого человека концентрация кальция в плазме колеблется в пределах 88—104 мг/л (2,2—2,6 мМ). В плазме он присутствует в виде свободных ионов, в связанном с белками виде и — немного — в виде способных к диффузии комплексов. Концентрация свободных ионов кальция влияет на нейромышечную возбудимость и другие функции клеток и находится под строгим гормональным контролем (главным образом, как описано ниже, со стороны паратиреоидного гормона). Важным фактором, определяющим концентрацию ионов кальция, является концентрация белков в сыворотке; главный белок, связывающий кальций, — альбумин. Одна из формул, дающих приблизительное представление о количестве связанного с белками кальция, имеет следующий вид:
% белковосвязанного Са = 8•альбумин (г/л) + 2•глобулпн (г/л) + 3. Другой способ расчета заключается в вычитании 10 мг/л из сывороточной концентрации кальция для каждых
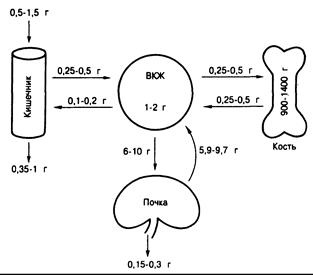
Рис. 335-2. Гомеостаз кальция.
Схематическое изображение содержания кальция во внеклеточном жидкости (ВКЖ), костях, а также пище и кале. Величины кальциевых потоков за сутки, рассчитанные различными методами, приведены рядом с путями транспорта в кишечнике, почках и скелете. Указаны приблизительные пределы колебаний, иллюстрирующие некоторые положения текста. Эффективность всасывания в кишечнике находится в обратной зависимости от содержания кальция в диете (хроническая адаптация). Это проявляется характерными колебаниями всасывающихся и выводимых с калом количеств. Показано, что при приеме 0,5 г всасывание составляет 50% (0,25 г), но при приеме 1.5 г оно снижается до 30% (0,5 г). Количество эндогенного кальция, секретируемого в просвет кишечника и поступающего в кал, постоянно и составляет 0,1—0,2 г в сутки. Оно не зависит ни от приема, ни от всасывания кальция. Фильтруемые, неабсорбируемые и экскретируемые почками количества кальция выбраны произвольно, чтобы подчеркнуть тот факт, что при низких скоростях фильтрации кальция (т. е. при низких скоростях клубочковой фильтрации) большая его часть реабсорбируется (например, 5,85 из 6 г) и экскреция с мочой составляет 150 мг; при более высоких скоростях фильтрации (при высоком потреблении кальция с пищей) реабсорбируется несколько меньшая его часть (например, 9,7 из 10 г) и экскреция с мочой оказывается более высокой — 300 мг. В любых условиях реабсорбция кальция в почках превышает 95% фильтруемой нагрузки. Поэтому, несмотря на то что прирост потребления кальция составляет 1,0 г, экскреция с мочой увеличивается только на 150 мг. В условиях кальциевого равновесия скорости высвобождения кальция из костей и поглощения его костной тканью равны.
10 г/л сывороточного альбумина ниже 40 г/л. Таким образом, концентрация ультрафильтруемого кальция составляет обычно около половины общей концентрации кальция. В большинстве лабораторий определяют только общий кальций, и для оценки концентрации ионов кальция важно знать концентрацию белков. Содержание свободных ионов можно определить с помощью специфических для кальция электродов.
Концентрация ионов кальция во внеклеточной жидкости сохраняется постоянной в результате взаимодействия процессов непрерывного поступления и выхода кальция из нее. Кальций поступает в плазму вследствие его всасывания в кишечнике и резорбции кости, а покидает внеклеточную жидкость с секретом желудочно-кишечного тракта, мочой, путем отложения в костной ткани и — в небольшом количестве — с потом. Процессы резорбции и формирования кости тесно связаны; ежесуточно кости скелета поглощают и выделяют примерно 0,5 мг кальция (рис. 335-2).
В США средняя диета обеспечивает прием около 0,6—1 г кальция в сутки, главным образом с молочными продуктами. Однако у взрослого человека всасывается меньше половины поступающего с пищей кальция. У детей в периоды быстрого роста, у женщин при беременности и лактации всасывание кальция увеличивается, а с возрастом снижается. При достаточном поступлении в организм витамина D и нормальном его метаболизме из пищи всасывается большее количество кальция (адаптация). Основная часть кальция всасывается в проксимальных отделах тонкого кишечника, в более дистальных сегментах эффективность всасывания снижается. Всасывание обусловлено как процессом активного транспорта, так и процессом ограниченной диффузии; первый из этих процессов имеет большее значение в верхних, а второй — в нижних отделах кишечника. На оба влияют метаболиты витамина D. Не все содержащиеся в пище формы кальция всасываются одинаково; имеет значение даже состав соли, в которой присутствует кальций: в виде хлорида он всасывается, очевидно, более эффективно, чем в виде других солей.
Кальций также секретируется в просвет желудочно-кишечного тракта. При внутривенном введении радиоактивных изотопов кальция они появляются в кале, что позволяет рассчитать количество эндогенного кальция кала (см. рис. 335-2). Другие методы дают завышенные цифры потерь кальция с содержимым кишечника. Секреция кальция в просвет кишечника постоянна и не зависит от его всасывания. При низком содержании кальция в пище (менее 500 мг в сутки) для поддержания положительного кальциевого баланса требуется всасывание более 30—40% его. Только в этом случае поглощение в кишечнике будет достаточным, чтобы компенсировать потери через секрецию желудочно-кишечным трактом и экскрецию почками.
У взрослых здоровых людей экскреция кальция с мочой при среднем потреблении его колеблется в пределах 100—400 мг в сутки. Когда поступление кальция с пищей менее 200 мг в сутки, экскреция его с мочой, как правило, составляет менее 200 мг в сутки. Однако у большинства здоровых людей широкие колебания потребления кальция с пищей сравнительно слабо влияют на его экскрецию с мочой. Это означает, что у лиц, получающих мало кальция с пищей, относительная неэффективность задержки его почками должна была бы обусловливать отрицательный кальциевый баланс, если бы всасывание кальция не достигало максимальной эффективности (см. рис. 335-2).
В моче появляется лишь малая часть того количества кальция, которое фильтруется в клубочках (около 6—10 г в сутки), но не исключено, что какие-то не связанные с белками неионные формы кальция (например, цитрат кальция) выводятся значительно быстрее, чем другие. На экскрецию кальция с мочой влияет и экскреция других электролитов. Например, содержание кальция в моче обычно пропорционально содержанию в ней натрия, другие ионы, такие как сульфат, также увеличивают экскрецию кальция.
Поддержание положительного баланса кальция (см. рис. 335-2) зависит от интенсивности его всасывания в кишечнике. Недостаточность паратиреоидного гормона или витамина D, заболевания кишечника или резкий дефицит кальция в пище могут предъявлять к кальциевому гомеостазу такие требования, которые не удастся компенсировать задержкой кальция почками, что приведет к отрицательному кальциевому балансу. Предотвратить снижение содержания кальция во внеклеточной жидкости даже в условиях хронического отрицательного кальциевого баланса способна усиленная резорбция костей, но только ценой прогрессирующей остеопении.
Патофизиология. Снижение концентрации свободных ионов кальция приводит к повышению нейромышечной возбудимости и появлению синдрома тетании. При полном проявлении этот синдром характеризуется периферическими и периоральными парестезиями, спазмом кистей и стоп, возбудимостью, судорогами, бронхоспазмом, ларингоспазмом, симптомами Хвостека, Труссо и Эрба и удлинением интервала Q—Т на электрокардиограмме. У детей тетания может проявляться раздражительностью и сонливостью. Уровень ионов кальция, определяющий возникновение отдельных признаков тетании, у разных людей неодинаков. На проявление тетании влияет и концентрация других компонентов внеклеточной жидкости. Например, гипомагниемия и алкалоз снижают порог тетании, тогда как гипокалиемия и ацидоз повышают его.
Увеличение уровня общего кальция в сыворотке крови сопровождается повышением и количества ионов кальция, что может проявляться анорексией, тошнотой, рвотой, запорами, гипотонией, депрессией, а иногда сонливостью и комой. Длительная гиперкальциемия, особенно при нормальном или повышенном уровне фосфата в сыворотке, может приводить к отложению твердой фазы кальция и фосфата в необычных для него местах, таких как стенки кровеносных сосудов, соединительная ткань вокруг суставов, слизистая оболочка желудка, роговица глаз и паренхима почек. Гиперкальциемия и сама по себе, помимо патологических кальцнй-фосфатных отложений в просвете почечных канальцев и интерстициальной ткани, способна нарушать функцию почек.
Метаболизм фосфора
Фосфор — не только важнейший компонент кости; он принадлежит к числу тех элементов, которыми наиболее богаты все ткани. В определенной форме он принимает участие почти во всех метаболических процессах. Общее содержание фосфора в организме здорового взрослого человека — около 1 кг, из которого примерно 85% находится в скелете.
В плазме натощак основная часть фосфора присутствует в виде неорганического ортофосфата с концентрацией фосфора 28—40 мг/л. Причем только 12% фосфора плазмы связано с белками. Примерно 75% общего фосфора плазмы в норме представлено свободными НРО42– и NaHPO4– и 10%—свободным Н2РО4–. Из-за разнообразия присутствующих в плазме соединений фосфора, что зависит от рН и других факторов, его концентрацию обычно выражают в единицах массы или молярности элементарного фосфора. Общий уровень фосфора выше у детей и обнаруживает тенденцию к росту у женщин после менопаузы. Суточные колебания концентрации фосфора наблюдаются даже при 24-часовом голодании; отчасти они опосредуются активностью коры надпочечников. Прием углеводов остро снижает содержание фосфора в сыворотке на 10—15 мг/л. По-видимому, это объясняется поглощением фосфора клетками и образованием фосфатных эфиров. Прием фосфора повышает его уровень в плазме. Поэтому для правильной оценки уровня фосфора в сыворотке и экскреции его с мочой важно брать пробы натощак. Алкалоз также снижает содержание фосфора в плазме.
Если из поступающего с пищей кальция в кишечнике всасывается лишь небольшая его доля, то фосфор всасывается гораздо эффективнее. При незначительном потреблении фосфора (менее 2 мг/кг массы тела в сутки) всасывается 80—90%) поступившего его количества. Даже при более высоком потреблении фосфора (больше 10 мг/кг массы тела в сутки) с молочными продуктами, кашами, яйцами и мясом всасывается около 70% его. Поэтому гипофосфатемии вследствие недостаточного всасывания 4зосфора в кишечнике почти не наблюдается, разве только при приеме больших количеств невсасывающихся антацидов; эти соединения связывают фосфор и препятствуют его всасыванию.
Регуляция фосфорного гомеостаза осуществляется в основном почками. Фильтруемый в клубочках фосфор в значительной степени реабсорбируется в проксимальных канальцах (существует также важная для гомеостаза дистальная реабсорбция), так что в норме с мочой выводится всего лишь 10—15% фильтруемой нагрузки. При уменьшении последней реабсорбция в проксимальных канальцах возрастает. И наоборот, при увеличении нагрузкифосфором канальцевая реабсорбция уменьшается и возрастает скорость его клиренса. Таким образом, экскреция фосфора с мочой в норме отражает его потребление с пищей, а задержка или выведение избыточных количеств этого иона определяется состоянием почечных механизмов (рис. 335-3). Убедительных доказательств канальцевой секреции фосфата в почках нет. Реабсорбция фосфора в проксимальных канальцах зависит от одновременной реабсорбции натрия, но если натрий, нереабсорбированный в этих канальцах, может реабсорбироваться дистальнее, то для фосфора такой возможности не существует. Поэтому увеличение объема жидкости и снижение реабсорбции натрия сопровождаются увеличением клиренса фосфора: точно так же проксимально действующие диуретики, такие как ацетазоламид, оказывают фосфатурический эффект в той же степени, что и натрийурический.
Патофизиология. Не существует непосредственных симптомов гиперфосфатемии. Однако когда содержание фосфора сохраняется на высоком уровне довольно долго, минерализация возрастает и фосфат кальция может откладываться не там, где нужно. Тяжело протекающая острая гипофосфатемия также не всегда сопровождается клиническими симптомами, но если они появляются, то можно наблюдать анорексию, головокружение, боли в костях, слабость проксимальной мускулатуры и утиную походку. При тяжело протекающей гипофосфатемии повышение уровня креатинфосфокиназы (КФК) в сыворотке крови свидетельствует о возможности присоединения к миопатии рабдомиолиза. В аналогичной последовательности появляются патологические изменения у экспериментальных животных при лишении их фосфата. При хронической гипофосфатемии отмечается тяжелая застойная кардиомиопатия. Восполнение дефицита фосфора приводило к быстрому исчезновению патологических сдвигов. Боли в костях и утиную походку объясняют остеомаляцией, которая развивается в результате снижения содержания фосфата. Мышечная слабость — это следствие либо прямого влияния гипофосфатемии на нервы и мышцы, либо — в некоторых случаях —эффект гиперпаратиреоза (первичного или вторичного), который
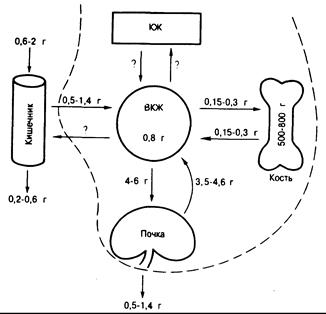
Рис. 335-3. Гомеостаз фосфата.
Схематическое изображение содержания неорганического фосфора (называемого здесь фосфатом) во внеклеточной жидкости (ВКЖ) и костях, а также пище и кале. Величины фосфорных потоков за сутки, рассчитанные различными методами, приведены рядом с путями транспорта в кишечнике, почках и скелете. Указанные пределы колебания величин иллюстрируют специфические аспекты метаболизма фосфора, обсуждаемые в тексте. Всасывание фосфора в кишечнике составляет 85% при низком его потреблении (0,5 г при потреблении 0,6 г) и 70% при более высоком потреблении (1,4 г при потреблении 2 г). Количество эндогенного фосфата в кале установлено не столь точно, как для кальция. При низком уровне потребления фосфора к невсосавшемуся его количеству добавляется не менее 0,15 г, что и обусловливает общую экскрецию с калом 0,2 г. При высоком потреблении фосфора с пищей поправка на эндогенный фосфат в кале не рассчитана. При любых уровнях потребления с мочой выводятся большие количества фосфора, чем это характерно для кальция при соответствующем его потреблении: выводимое количество тесно сопряжено с всосавшимся количеством, что и поддерживает фосфорный баланс (на этой схеме отсутствует поправка на эндогенный фосфат в кале). Следует обратить внимание на то, что в отличие от высокой и относительно постоянной реабсорбции кальция в почках почечная реабсорбция фосфора колеблется от 75% фильтруемой нагрузки до более 85% ее. Пространство, обозначенное КЖ, отражает уровень внутриклеточного органического и неорганического фосфора. Быстрое поступление фосфора в клетки (и соответственно выход его из клеток, который осуществляется. вероятно, медленнее) вносит свой вклад в изменение количества фосфора во ВКЖ. Эти перемещения фосфора между ВКЖ и КЖ, а также высвобождение и поглощение фосфора костной тканью в условиях фосфорного баланса равны.
может играть роль в этиологии гипофосфатемии. Иногда снижение уровня фосфата обусловливает и нарушение роста у детей. Гипофосфатемия приводит к снижению уровней 2,3-дифосфоглицериновой кислоты и аденозинтрифосфата (АТФ) в эритроцитах, что в свою очередь ведет к нарушению диссоциации оксигемоглобина, обусловливая меньшую доставку кислорода к тканям. В результате нарушения способности эритроцитов деформироваться в мелких сосудах может развиваться и гемолитическая анемия.
Недостаточность всасывания фосфора в кишечнике редко приводит к отрицательному фосфорному балансу (см. рис. 335-3), и поддержание нормального баланса фосфора зависит от эффективности экскреции или задержки его почками. При тяжелой почечной недостаточности из-за нарушения почечного клиренса фосфора развивается гиперфосфатемия. Врожденные или приобретенные дефекты почечных канальцев могут обусловливать гипофосфатемию вследствие недостаточной задержки фосфора в организме.
Дата добавления: 2015-07-22; просмотров: 2034;
