ГЛАВА 216. РЕСПИРАТОРНЫЙ ДИСТРЕСС-СИНДРОМ ВЗРОСЛЫХ
Роланд Г. Ингрэм, младший (Roland H. Ingram, Sr.)
Респираторный дистресс-синдром взрослых (РДСВ)— описательный термин, принятый для обозначения разнородной по этиологии группы острых легочных поражений, характеризующихся диффузной инфильтрацией ткани легких и выраженной артериальной гипоксемией. Этот термин был предложен ввиду известного клинико-морфологического сходства данной патологии с респираторным дистресс-синдромом новорожденных. Однако в основе развития данного синдрома у новорожденных лежат несовершенная продукция сурфактанта и чрезмерная податливость грудной клетки, тогда как у взрослых нарушения продукции сурфактанта носят вторичный характер, а упругость грудной клетки не изменяется. Несмотря на большое число этиологических факторов (табл. 216-1), клинические проявления, характер патофизиологических нарушений и лечебная тактика во всех случаях развития РДСВ оказываются сходными.
Естественно, что представленные выше заболевания и патологические состояния отнюдь не всегда приводят к формированию острой дыхательной недостаточности и их специфическое лечение разнится в каждом конкретном случае. В этой же главе основное внимание будет уделено тому общему, что объединяет данную патологию, а именно синдрому острой дыхательной недостаточности.
Патофизиология. Вне зависимости от конкретного этиологического фактора РДСВ во всех случаях характеризуется гипергидратацией легочной ткани. Являясь одной из форм отека легких, РДСВ принципиально отличается от кардиогенного отека легких нормальными значениями гидростатического давления в легочных капиллярах (гл. 26). Поскольку гидростатическое легочное капиллярное давление остается неизменным, то основным патогенетическим механизмом развития отека легких при РДСВ служит патологическое повышение проницаемости альвеолярно-капиллярной мембраны либо вследствие прямого повреждающего действия ингалируемых токсичных газов или аспирируемого кислого содержимого желудка, либо вследствие опосредованного влияния, оказываемого активированными и агрегированными форменными элементами крови (последнее имеет место при сепсисе и/или эндотоксемии). Агрегация тромбоцитов, закономерно обнаруживаемая при РДСФ, способствует прилипанию нейтрофильных лейкоцитов к эндотелию легочных сосудов, которые подвергаются повреждающему действию оксидантов, что в свою очередь приводит к высвобождению таких противовоспалительных медиаторов, как лейкотриены, тромбоксан, простагландины. Поначалу нарушения проницаемости альвеолярно-капиллярной мембраны ведут к пропотеванию жидкой части крови, содержащей макромо-лекулярные соединения и клеточные фрагменты, из внутрисосудистого в интерстициальное пространство, а затем и в просвет альвеол. Выходу белков за пределы сосудистого русла не препятствует гидростатический градиент, в связи с чем даже минимальное повышение легочного капиллярного давления характеризуется резким возрастанием отечности интерстиция и альвеолярных пространство. Внутриальвеолярное накопление жидкости, особенно содержащей фибриноген, способствует коллапсу альвеол, что объясняется как падением актуальной активности сурфактанта, так и нарушениями его продукции гранулярными пневмонитами. И хотя рентгенологические исследования демонстрируют диффузный характер легочного поражения, регионарные нарушения при РДСВ неоднородны; последнее проявляется различной выраженностью вентиляционно-перфузионных расстройств вследствие внутрилегочного шунтирования участков, содержащих коллабированные или заполненные жидкостью альвеолы. При этом легкие становятся менее растяжимыми (эластичными), что связывается с интерстициальным отеком и альвеолярным коллапсом. Вследствие снижения эластических свойств легочной ткани возрастает работа дыхательной мускулатуры. Последнее приводит к развитию синдрома усталости дыхательных мышц, что сопровождается уменьшением дыхательных объемов вдоха и выдоха, нарушениями газообмена. Гипоксемия, стимуляция рецепторов ригидной легочной паренхимы, приводят к учащению дыхательных экскурсий, падению дыхательных объемов и дальнейшему усугублению нарушений газообмена.
Таблица 216-1. Патологические состояния, приводящие к развитию респираторного дистресс-синдрома взрослых
Генерализованные легочные инфекции (вирусные, бактериальные, грибковые, пневмоцистная)
Аспирация (например, желудочным содержимым при синдроме Мендельсона, водой при утоплении)
Ингаляция токсичных газов и ирритантов (например, хлора, NO2 табачного дыма, озона, кислорода в высоких концентрациях)
Отек легких вследствие передозировки наркотических средств (например, героина, метадона, морфина, декстропропоксифена)
Побочные эффекты ненаркотических препаратов (например, нитрофуранов)
Аутоиммунные нарушения (например, при синдроме Гудпасчера, системной красной волчанке)
Травматический шок («шоковое легкое»)
Грамотрицательный сепсис, геморрагический панкреатит, эмболия легочной артерии амниотической жидкостью, жировая эмболия
Осложнения операции пересадки комплекса «легкие—сердце» («постперфузионное легкое»)
Патологические изменения. Патологические изменения в легких, выявляемые при РДСВ, оказываются сходными вне зависимости от конкретного этиологического фактора, что доказывает справедливость известного положения о том, что легкие «отвечают» на самые различные повреждающие воздействия достаточно ограниченным, стереотипным набором патологических изменений. Как правило, легкие отечны, безвоздушны, с участками геморрагии, ателектазов и уплотнений. При световой микроскопии выявляют отек и клеточную инфильтрацию межальвеолярных перегородок и интерстициального пространства, окружающего воздухоносные пути, а также гиалиновые мембраны во многих участках легких, стаз эритроцитов, тромбоцитарные и гранулоцитарные агрегаты в очагах альвеолярных и интерстициальных геморрагии. Нередко при этом отмечают гиперплазию и дисплазию гранулярных пневмонитов.
Если длительность течения РДСВ составляет более 10 сут, то в дополнение к вышеприведенным морфологическим «находкам» обнаруживают фиброз легочной ткани. В случаях выздоровления или смерти в последующем от какой-либо другой причины в легких выявляют выраженный интерстициальный фиброз и эмфизематозные изменения. Впрочем, при адекватном лечении значительная часть больных полностью выздоравливает и при последующем проспективном наблюдении у них не отмечают каких-либо нарушений со стороны дыхательной системы.
Клинические проявления. Непосредственно в момент развития того или иного первичного заболевания или патологического состояния и в течение последующих нескольких часов больной, как правило, не предъявляет никаких жалоб. Первый и наиболее ранний признак РДСВ — это одышка. При исследовании газового состава крови в этот период отмечают снижение Рог, что на фоне низких значений Рсс>2 характеризуется увеличением альвеолярно-артериальной разницы по кислороду (гл. 200). На этой стадии использование ингаляций кислорода через лицевую маску или носовой катетер приводит к значительному повышению Ро2 в артериальной крови. Столь быстрое возрастание Ро2 указывает на имеющиеся вентиляционно-перфузионные расстройства, и, возможно, диффузный характер патологических изменений в легких поначалу сопровождается увеличением альвеолярно-артериальной разницы по кислороду (РАо2—Рао2).
Физикальное обследование обычно малоинформативно; лишь в редких случаях удается выслушать незвучную инспираторную крепитацию. В этот период на рентгенограммах органов грудной клетки легкие представляются интактными либо визуализируется незначительная интерстициальная инфильтрация. По мере прогрессирования патологического процесса явления дыхательной недостаточности нарастают (возрастает частота дыханий, появляется диффузный цианоз кожных покровов). Над всеми легочными полями выслушивается звучная крепитация, дыхание становится шумным, клокочущим; на рентгенограмме органов грудной клетки отмечают распространенную многофокусную альвеолярную и интерстициальную инфильтрацию (рис. 216-1).
На этом этапе развития заболевания уже не удается осуществить коррекцию нарушений газообмена с помощью ингаляций кислорода через носовой катетер или лицевую маску и приходится прибегать к искусственной вентиляции легких (ИВЛ). Сброс (шунтирование) крови «справо налево» через коллабированные или заполненные- жидкостью альвеолы становится ведущим патогенетическим механизмом прогрессирования артериальной гипоксемии. Однако, несмотря на выраженность вентиляционно-перфузионных расстройств и наличие альвеолярного шунта, альвеолярно-артериальная разница по кислороду (РАо2 — Рао2) при ингаляции кислородом остается повышенной. Использование же ИВЛ с положительным давлением в конце выдоха характеризуется увеличением дыхательных объемов, восстановлением альвеолярной стабильности, уменьшением явлений внутрилегочного шунтирования. Если же на фоне ИВЛ с положительным давлением в конце выдоха не удается добиться отчетливого положительного эффекта, то тогда регистрируется прогрессирующее снижение дыхательных объемов вследствие альвеолярной гиповентиляции, повышается РСО2, усугубляется гипоксемия, что в совокупности указывает на крайне неблагоприятный прогноз.
Лечебная тактика при гипоксемической дыхательной недостаточности. Очевидно, что наилучшим лечебным подходом окажется тот, при котором имеется возможность, используя наименьшую концентрацию кислорода в ингалируемой газовой смеси, добиться улучшения состояния газообмена. В этом плане следует обратиться к кривой диссоциации оксигемоглобина. Так, если РО2 составляет 60 мм рт. ст., то процент насыщения гемоглобина кислородом (процент сатурации) приближается к 90. Исходя из этого можно заключить, что достижение Рао2 на уровне 60 мм рт. ст. является-оптимальным, поскольку большее возрастание этого показателя, характеризуясь минимальным приростом оксигенации, несет в себе реальный риск развития кислородного отравления. В отличие от дыхательной недостаточности, осложняющей течение хронических обструктивных заболеваний легких (гл. 208), гипоксемическая дыхательная недостаточность не сопровождается угнетением дыхания. Существует немало способов кислородотерапии — ингаляции через носовые канюли, лицевую (ротоносовую) маску, через лицевую маску с расходным мешком. Эффективная концентрация кислорода, поступающего в начальный отрезок трахеи, определяется с учетом актуальной концентрации О2 во вдыхаемой газовой смеси, скорости воздушного потока и минутного объема дыхания. При гипоксемической форме дыхательной недостаточности целесообразно начать с относительно небольших скоростей потока кислорода (порядка 5—10 л-мин–1 в пересчете на 100% О2). При этом осуществляют динамический контроль за газовым составом крови, позволяя при необходимости уменьшить скорость потока вдыхаемой газовой смеси и концентрацию в ней кислорода.
Если же на фоне применения того или иного метода кислородотерапии не удается добиться адекватной оксигенации артериальной крови, то тогда, безусловно, показана интубация трахеи и проведение ИВЛ. Здесь, однако, важно следующее принципиальное замечание — если у больного на фоне гипервентиляции возрастает средний объем легких, но не увеличивается вентиляция, то тогда до начала ИВЛ необходимо восстановить проходимость периферических дыхательных путей.
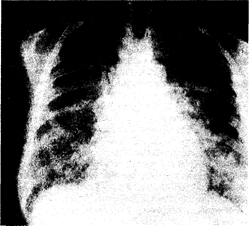
Рис. 216-1. Рентгенограмма органов грудной клетки (прямая проекция) больного с респираторным дистресс-синдромом взрослых, развившимся на почве вирусной пневмонии тяжелого течения.
Подобные рентгенологические изменения типичны для всех заболеваний и патологических состояний, указанных в табл. 216-1, и клинически сопровождаются явлениями острой дыхательной недостаточности. Сходная скиалогическая картина наблюдается при развитии отека легких на почве левожелудочковой недостаточности (гл. 26). Внезапное развитие РДСВ вынуждает ограничиваться рентгенографией органов грудной клетки в положении лежа; кроме того, ввиду тяжести состояния больные не в состоянии осуществить полноценный вдох и задержку дыхания. При этом на рентгенограмме нередко визуализируется кажущееся расширение сердечно-сосудистой тени, что иногда порождает гипердиагностику кардиогенного отека легких.
При ИВЛ обычно используются большие дыхательные объемы (в среднем около 15 мл на 1 кг массы тела) при частоте вентиляции, меньшей чем частота спонтанного дыхания (12— 15 в 1 мин). Предпочтение следует отдавать автоматическим респираторам, работающим на волюметрическом (а не на прессоциклическом) принципе переключения фаз дыхательного цикла. Если больной при вдувании газовой смеси развивает значительные экспираторные усилия, то это может привести к возрастанию пикового инспираторного давления, в результате чего закрывается специальный клапан и ограничиваются дыхательные объемы. Поэтому для адаптации больного к респиратору (синхронизации с собственными дыхательными движениями) необходимо использовать седативные средства, миорелаксанты.
Наиболее оправданным у больных РДСВ представляется использование синхронизированной интермиттирующей принудительной вентиляции. При этом пациент сохраняет возможность осуществлять спонтанные дыхательные движения, периодически прерываемые принудительными вдуваниями газовой смеси. И лишь в случае, если частота спонтанного дыхания столь высока, что не удается добиться синхронизации спонтанного и аппаратного дыхания, приходится прибегать к помощи седативных средств и миорелаксантов.
При достижении Рао2, превышающего 60 мм рт. ст., необходимо далее снизить концентрацию кислорода во вдыхаемой газовой смеси. Если концентра ция О2 оказывается ниже или равной 0,6 при Рао2>60 мм рт. ст., то ИВЛ в данном режиме можно продолжать так долго, как этого требует конкретная клиническая ситуация. Существуют два основных показания для проведения ИВЛ с положительным давлением в конце выдоха, при которой происходит расправление коллабированных альвеолярных пространств и увеличение функциональной емкости легких. Во-первых, когда не удается снизить концентрацию O2 во вдыхаемой смеси ниже 0,6 и, во-вторых, не удается достигнуть Рао2>60 мм рт. ст., либо же адекватная оксигенация артериальной крови достигается при концентрации O2, близкой к 1.
Критериями адекватности проводимой ИВЛ в режиме положительного давления в конце выдоха являются оптимальный уровень Рао2 и отсутствие сердечнососудистых осложнений, обусловленных повышением системного артериального давления, наиболее серьезным из которых представляется падение сердечного выброса. Существует несколько объяснений этого гемодинамического феномена. Во-первых, повышение внутриплеврального давления непосредственно приводит к снижению венозного возврата к сердцу, что лишь отчасти может быть компенсировано периферической веноконстрикцией. Во-вторых, при данном режиме ИВЛ увеличение дыхательных объемов сопровождается повышением легочного сосудистого сопротивления, что в свою очередь ведет к возрастанию внутрижелудочкового давления и дилатации полости правого желудочка. Результатом последнего является пролабирование (выбухание) межжелудочковой перегородки в полость левого желудочка, что сопровождается нарушением диастолического наполнения левого желудочка и падением сердечного выброса. Кроме того, нарушения диастолического наполнения желудочков могут быть обусловлены сдавлением сердца ригидной легочной тканью. С физиологической точки зрения оптимальным следует считать такую величину положительного давления в конце выдоха, при которой удается достигнуть максимального транспорта кислорода (данный показатель определяется как произведение величины сердечного выброса на содержание кислорода в артериальной крови).
У больных, находящихся в критическом и/или нестабильном состоянии, необходимо ввести катетер в лучевую артерию и установить баллонный катетер Свана—Ганца (Swan—Ganz) в легочную артерию. При этом может быть получена весьма ценная информация, позволяющая оценить эффективность аппаратной вентиляции, а также определить основные направления поддерживающего (симптоматического) лечения. Используя, в частности, катетер Свана— Ганца (Swan—Ganz), можно определить величину давления в легочной артерии, легочного капиллярного давления «заклинивания», сердечного выброса (используя методику термодилюции), а также оценить максимальный транспорт кислорода в пробах смешанной венозной крови. При этом, однако, необходимо учитывать все превходящие факторы, извращающие истинные значения анализируемых гемодинамических показателей. Так, при проведении ИВЛ в режиме положительного давления в конце выдоха следует принимать во внимание внутри-грудное сосудистое давление, соотносящееся с атмосферным давлением. Если внутриплевральное давление оказывается больше атмосферного, что, как правило, и бывает при данном режиме ИВЛ, то истинное эффективное давление (разность внутрисосудистого и внутриплеврального давления) должно быть определено в ходе повторных исследований. Оптимальным представляется измерение давления в легочной артерии непосредственно перед очередным вдуванием газовой смеси; при этом от полученных значений следует вычесть 1/2 величины положительного давления в конце выдоха.
Учитывая повышенную проницаемость альвеолярно-капиллярной мембраны, у больных РДСВ легочное капиллярное давление «заклинивания» зависит от величины сердечного выброса, уровня системного артериального давления и диуреза. В последнее время в лечении подобных больных стали с успехом использовать препараты, обладающие инотроиным и селективным вазоактивным эффектами (в частности, дофамин).
Показатель Ро2 в смешанной венозной крови давно используют в качестве критерия адекватности проводимой оксигенотерапии. Низкие значения Ро2 (< 20 мм рт. ст.) указывают на тканевую гипоксемию вне зависимости от актуальной величины сердечного выброса и Pao2. Однако высокие значения Рог в смешанной венозной крови еще не исключают наличия выраженной гипоксии тканей, особенно при развитии грамотрицательного сепсиса, поскольку в данной клинической ситуации имеют место лабильные системные шунты и как следствие этого недостаточная перфузия отдельных участков капиллярного русла.
Определенное влияние на эффективность проводимой оксигенотерапии оказывает и положение тела пациента. Хотя при РДСВ легкие диффузно вовлекаются в патологический процесс, тем не менее степень выраженности изменений в различных участках легких может существенно разниться. В этой связи при наличии некоторой асимметрии поражения больной должен находится в положении на боку (причем менее пораженное легкое должно оказаться внизу). Последнее объясняется тем, что легочный кровоток вследствие силы тяжести оказывается наибольшим в нижележащем легком; если же нижерасположенным оказывается более пораженное легкое, то это приводит к увеличению внутрилегочного (альвеолярного) шунтирования, обнаруживающего себя падением Рао2. Вот почему при проведении тех или иных лечебных манипуляций необходимо избрать оптимальное положение больного в кровати.
Изредка для поддержания адекватного уровня артериальной оксигенации прибегают к повышению положительного давления в конце выдоха. Однако при этом может наблюдаться парадоксальное снижение Рао2. Объяснение этого феномена следующее: высокое давление в конце выдоха не в состоянии расправить все спавшиеся альвеолы, но может привести к перераздуванию отдельных участков легочной ткани. В этих участках повышается сосудистое сопротивление и часть крови устремляется в невентилируемые зоны легких, что еще больше усугубляет явления альвеолярного шунтирования. В данной ситуации необходимо уменьшить величину положительного давления в конце выдоха до такого уровня, при котором регистрировалась бы наибольшая величина транспорта кислорода (произведение сердечного выброса на Рао2).
Когда же, используя максимальные значения положительного давления в конце выдоха и концентрацию кислорода в газовой смеси, близкую к 1, не удается достигнуть адекватного газообмена, может быть использована экстракорпоральная мембранная оксигенация (ЭКМО). Однако, несмотря на то что данный лечебный подход и позволяет поддерживать оптимальную оксигенацию крови, по свидетельству масштабных проспективных исследований не удалось продемонстрировать отчетливого влияния ЭКМО на показатели выживаемости в группе больных с острой гипоксемической дыхательной недостаточностью.
Осложнения РДСВ. Прогрессирование клинических и рентгенологических проявлений РДСВ наряду с симптомами первичного заболевания (патологического состояния) нередко затмевают иные возможные осложнения. Одно из них — левожелудочковая недостаточность. Это, впрочем, не является неожиданностью, поскольку у всех больных независимо от наличия или отсутствия левожелудочковой недостаточности в легких выслушиваются диффузные влажные хрипы и крепитация; существенно и то, что данные акустические симптомы затрудняют обнаружение ритма галопа. Кроме того, при производстве рентгеновских снимков органов грудной клетки в прямой проекции с помощью переносных установок, часто при недостаточно полноценном вдохе и невозможности задержать дыхание, размеры сердечно-сосудистой тени представляются увеличенными. В этой связи диагностика левожелудочковой недостаточности у больных с РДСВ, основанная на анализе клинических и рентгенологических данных, крайне сложна, если вообще возможна. В данной клинической ситуации для исключения левожелудочковой недостаточности необходима катетеризация легочной артерии баллонным катетером Свана—Ганца (Swan— Ganz) и динамическое определение давления «заклинивания», а также содержания кислорода в смешанной венозной крови.
Очевидно, что наличие на рентгенограмме органов грудной клетки у больных с РДСВ многофокусной альвеолярной инфильтрации легочной ткани затрудняет диагностику вторичной бактериальной пневмонии, что вынуждает проводить повторные бактериоскопические и бактериологические исследования бронхиального секрета, особенно у лихорадящих пациентов. При ряде заболеваний и патологических состояний — грамотрицательном сепсисе, остром геморрагическом панкреатите, «шоковом легком» — закономерно развивается синдром диссеминированного внутрисосудистого свертывания (гл. 281), характеризующийся, в частности, желудочно-кишечными и легочными кровотечениями. В этой связи динамический контроль числа тромбоцитов, уровня фибриногенемии, показателей частичного тромбопластинового и протромбинового времени дает возможность своевременно диагностировать это грозное осложнение и начать целенаправленное лечение.
В ряде случаев может иметь место обструкция главного бронха эндотрахеальной или трахеостомической трубкой. Трубки, будучи слишком длинными или плохо зафиксированными, смещаются в один из главных бронхов, чаще правый (поскольку он отходит под небольшим углом от трахеи). В результате закупорки бронха развивается ателектаз легкого, что клинически проявляется усугублением явлений дыхательной недостаточности, а при физикальном обследовании отмечают исчезновение дыхательных шумов над спавшимся легким. Для восстановления бронхиальной проходимости необходимо оттянуть трубку назад и прочно зафиксировать ее в этом положении.
При проведении ИВЛ с положительным давлением в конце выдоха вследствие разрыва бронхов или альвеол может развиться пневмоторакс или пневмомедиастинум (их диагностика возможна лишь при проведении рентгенографии органов грудной клетки). Иногда при этом ключом к диагностике является обнаружение подкожной эмфиземы. Учитывая реальную возможность развития данных осложнений у больных, находящихся на аппаратном дыхании, необходимы повторные рентгеновские исследования органов грудной клетки. Если же состояние пациента резко ухудшается, то следует сразу же заподозрить напряженный пневмоторакс и при наличии соответствующей клинической симптоматики необходимо немедленно, не дожидаясь рентгенологического подтверждения, наладить систему плевральной аспирации.
Важно помнить, что при длительном использовании высоких концентраций кислорода в ингалируемой дыхательной смеси (более или равной 0,6) может развиться симптомокомплекс, клинико-рентгенологически идентичный РДСВ. Вот почему при проведении ИВЛ для достижения адекватного газообмена используется минимально возможная концентрация кислорода.
Перевод больного с аппаратного на спонтанное дыхание. Показаниями для перевода больного на спонтанное дыхание являются возможное снижение концентрации кислорода во вдыхаемой газовой смеси, уменьшение давления вдувания в ходе принудительной или вспомогательной вентиляции, частота спонтанного дыхания менее 30 в 1 мин; при этом величины дыхательных объемов должны быть равны или превышать 5 мл/кг, жизненной емкости легких—15 мл/кг, а статического инспираторного давления— 20 см вод. ст. Однако, несмотря на кажущуюся определенность приведенных критериев, при переводе больного с аппаратного на спонтанное дыхание в части случаев необходимы повторные («тренирующие») отлучения от респиратора. В этом плане оптимальным представляется использование синхронизированной интермиттирующей принудительной вентиляции, когда в переходный период (от аппаратного дыхания к спонтанному) постепенно уменьшают частоту вдуваний газовой смеси.
Прогноз. Учитывая этиологическую разнородность РДСВ и неодинаковую частоту его развития при том или ином заболевании, весьма сложно, если вообще возможно, охарактеризовать прогностические аспекты данного патологического состояния. Еще относительно недавно летальность при РДСВ достигала 100%; в настоящее же время на фоне использования современных подходов диагностики и интенсивной респираторной терапии этот показатель снизился до 50—60%. Если РДСВ развивается на почве передозировки наркотиков, то в этом случае прогноз оценивается достаточно оптимистично. В противоположность этому развитие РДСВ у больных с шоком характеризуется весьма высокими показателями летальности. Неблагоприятен также прогноз и у больных с сепсисом при наличии мультиорганной недостаточности (печеночной, почечной): развитие в подобной клинической ситуации РДСВ, несмотря на проводимую интенсивную дыхательную и сердечно-сосудистую терапию, характеризуется практически 100% летальностью. При иной этиологии РДСВ к прогностически неблагоприятным факторам относятся возрастание альвеолярно-артериальной разницы по кислороду (PAoz—Рао2). вынужденное повышение концентрации кислорода во вдыхаемой газовой смеси и величины положительного давления в конце выдоха, снижение эластических свойств легочной ткани вследствие вынужденного повышения давления вдувания газовой смеси, развитие системной артериальной гипотензии, резистентной к коррекции объема циркулирующей крови.
У лиц с исходно нормальными показателями функции легких, переживших РДСВ, долговременный прогноз оценивается вполне благоприятно; при этом дыхательные объемы и показатели газового состава крови возвращаются к исходно нормальному уровню спустя 4 — 6 мес после перенесенного эпизода острой дыхательной недостаточности. Впрочем, при наличии остаточного пневмофиброза полного функционального выздоровления может и не наступить.
Дата добавления: 2015-07-22; просмотров: 1061;
