Лечение. Преждевременные желудочковые сокращения (желудочковые экстрасистолы)
Аритмии (см. также гл. 183 и 184). Успехи в коррекции аритмий представляют собой наиболее значительное достижение в лечении больных с инфарктом миокарда.
Преждевременные желудочковые сокращения (желудочковые экстрасистолы). Редкие спорадические желудочковые экстрасистолы возникают у большинства больных с острым инфарктом миокарда и не требуют специального лечения. Обычно считается, что антиаритмическая терапия при желудочковой экстрасистолии должна назначаться в следующих случаях: 1) наличие более 5 одиночных желудочковых экстрасистол в 1 мин.; 2) возникновение групповых или политопных желудочковых экстрасистол; 3) возникновение желудочковых экстрасистол в фазу ранней диастолы, т. е. накладывающихся на зубец Т предыдущего комплекса (т. е. феномен R на Т).
Внутривенное введение лидокаина стало лечением выбора при желудочковой экстрасистолии и желудочковых аритмиях, так как препарат начинает действовать быстро и так же быстро исчезают побочные эффекты (в течение 15— 20 мин после прекращения введения). Для быстрого достижения терапевтической концентрации в крови лидокаин назначают в виде болюса 1 мг/кг внутривенно. Эта начальная доза может устранить эктопическую активность, а затем для поддержания эффекта проводят постоянную инфузию со скоростью 2 — 4 мг/мин. Если аритмия сохраняется, через 10 мин после введения первого болюса вводят второй в дозе 0,5 мг/кг. У больных с застойной сердечной недостаточностью, заболеваниями печени, шоком дозу лидокаина уменьшают вдвое. Как правило, желудочковая экстрасистолия исчезает спонтанно через 72—96 ч. В том случае, если значительная желудочковая аритмия сохраняется и после этого, назначают длительную антиаритмическую терапию.
Для лечения больных с постоянными желудочковыми аритмиями обычно используют новокаинамид, токайнид (Tocainide), хинидин. БАБ и дизопирамид также устраняют желудочковые нарушения ритма у больных с острым инфарктом миокарда. Больным с левожелудочковой недостаточностью дизопирамид назначают с большой осторожностью, так как он обладает существенным отрицательным инотропным действием. Если эти средства (гл. 184), используемые в виде монотерапии или в комбинациях, неэффективны в обычных дозах, следует определить их концентрацию в крови. При назначении больших доз этих препаратов необходим регулярный клинический и ЭКГ-контроль для выявления возможных признаков интоксикации.
Желудочковая тахикардия и фибрилляция желудочков. В течение первых 24 ч ОИМ желудочковая тахикардия (ЖТ) и фибрилляция желудочков (ФЖ) часто возникают без предшествующих им угрожающих нарушений ритма. Риск развития таких первичных аритмий может быть существенно уменьшен с помощью профилактического внутривенного введения лидокаина. Профилактическое назначение антиаритмических препаратов особенно показано больным, которые не могут быть помещены в клинику, или находятся в клинике, где в БИТе не обеспечено постоянное присутствие врача. При продолжительной желудочковой тахикардии в первую очередь назначают лидокаин. Если после одного-двух введений препарата в дозе 50—100 мг аритмия сохраняется, проводят электроимпульсную терапию (электрокардиоверсия) (гл. 184). Электрическую дефибрилляцию проводят сразу же при фибрилляции желудочков, а также в тех случаях, когда желудочковая тахикардия вызывает нарушения гемодинамики. Если фибрилляция желудочков продолжается несколько секунд и более, первый разряд дефибриллятора может быть безуспешным, в этих случаях перед проведением повторной кардиоверсии желательно осуществить непрямой массаж сердца, искусственную вентиляцию легких «изо рта в рот», а также внутривенно ввести бикарбонат натрия (40—90 мэкв). Улучшение оксигенации и перфузии тканей и коррекция ацидоза увеличивают вероятность успешной дефибрилляции (см. также гл. 30). При рефрактерных к терапии фибрилляции желудочков или желудочковой тахикардии может быть эффективным введение бретилия (орнид). При фибрилляции желудочков бретилий назначают в виде болюса в 5 мг/кг, затем повторяют дефибрилляцию. Если последняя не приносит результата, для облегчения дефибрилляции вводят еще один болюс бретилия (10 мг/кг). Желудочковую тахикардию можно устранить медленным введением бретилия в дозе 10 мг/кг в течение 10 мин. При рецидивах аритмий после введения первой дозы бретилия можно осуществить постоянную его инфузию в дозе 2 мг/мин. После внутривенного введения бретилия может возникнуть выраженная ортостатическая гипотензия. Поэтому во время и после введения препарата больные должны находиться в положении лежа, кроме того, следует быть готовым к внутривенному введению жидкостей.
При первичной фибрилляции желудочков длительный прогноз благоприятный. Это означает, что первичная фибрилляция желудочков является следствием острой ишемии и не связана с наличием таких предрасполагающих к ней факторов, как застойная сердечная недостаточность, блокада ножек пучка Гиса, аневризма левого желудочка. По данным одного из исследований, 87 % больных с первичной фибрилляцией желудочков остались живы и были выписаны из клиники. Прогноз у больных с вторичной фибрилляцией желудочков, развившейся вследствие недостаточной насосной функции сердца, гораздо менее благоприятный. Лишь 29 % из них остаются в живых.
В группе больных, у которых желудочковая тахикардия развивается в поздние, сроки госпитализации, смертность в течение года достигает 85%. Таким больным необходимо проведение электрофизиологического исследования (гл. 184).
Ускоренный идиовентрикулярный ритм. Ускоренный идиовентрикулярный ритм («медленная желудочковая тахикардия») — это желудочковый ритм с частотой от 60 до 100 в 1 мин. Он возникает у 25 % больных с инфарктом миокарда. Чаще всего он регистрируется у больных с нижнезадним инфарктом миокарда и, как правило, в сочетании с синусовой брадикардией. Частота сердечных сокращений при ускоренном идиовентрикулярном ритме аналогична таковой при синусовом ритме, предшествующем ему или следующем за ним. Ускоренный идиовентрикулярный ритм трудно диагностировать клинически, его выявляют лишь с помощью ЭКГ-мониторирования. Это связано с тем, что частота сокращений желудочков мало отличается от таковой при синусовом ритме, а нарушения гемодинамики минимальны. Ускоренный идиовентрикулярный ритм возникает и исчезает спонтанно по мере того, как колебания синусового ритма вызывают замедление ритма предсердий ниже ускоренного ускользающего уровня. В целом ускоренный идиовентрикулярный ритм является доброкачественным нарушением ритма и не знаменует собой начало классической желудочковой тахикардии. Однако зарегистрирован ряд случаев, когда ускоренный идиовентрикулярный ритм сочетался с более опасными формами желудочковых аритмий или трансформировался в жизненно опасные желудочковые нарушения ритма. Большинство больных с ускоренным идиовентрикулярным ритмом не требуют лечения. Достаточно тщательного мониторирования ЭКГ, поскольку ускоренный идиовентрикулярный ритм редко переходит в более серьезные нарушения ритма. Если же последнее все' же случается, ускоренный идиовентрикулярный ритм может быть легко устранен с. помощью препаратов, уменьшающих частоту выскальзывающего желудочкового ритма, например токаинида, и/или препаратов, учащающих синусовый ритм (атропин).
Суправентрикулярная аритмия. В этой группе больных чаще всего возникают такие суправентрикулярные аритмии, как узловой ритм и узловая тахикардия, предсердная тахикардия, трепетание и мерцание предсердий. Эти нарушения ритма чаще всего являются вторичными по отношению к левожелудочковой недостаточности. Для лечения больных обычно используют дигоксин. Если патологический ритм сохраняется в течение более двух часов и частота желудочковых сокращений при этом превышает 120 в 1 мин или если тахикардия сопровождается появлением сердечной недостаточности, шока или ишемии (о чем свидетельствуют повторные боли или изменения на ЭКГ), то показано проведение электроимпульсной терапии.
Узловые нарушения ритма имеют различную этиологию, они не свидетельствуют о наличии какой-то специфической патологии, поэтому отношение врача к подобным больным должно быть индивидуализированным. Необходимо исключить передозировку дигиталиса как причину узловых аритмий. У некоторых больных со значительно нарушенной функцией левого желудочка утрата нормальной продолжительности систолы предсердий приводит к значительному падению сердечного выброса. В таких случаях показано проведение предсердной стимуляции или стимуляции венечного (коронарного) синуса. Гемодинамическое действие стимуляции этих двух видов идентичное, однако преимущество стимуляции венечного (коронарного) синуса состоит в том, что при этом достигается более стабильное положение катетера.
Синусовая брадикардия. Мнения о значении брадикардии как фактора, предрасполагающего к развитию фибрилляции желудочков, противоречивы. С одной стороны, известно, что частота желудочковой тахикардии у больных с продолжительной синусовой брадикардией в 2 раза больше, чем у больных с нормальной частотой сердечных сокращений. С другой стороны, синусовую брадикардию у госпитализированных больных рассматривают как показатель благоприятного прогноза. Опыт использования передвижных блоков интенсивной кардиологической помощи свидетельствует о том, что синусовая брадикардия, возникающая в первые часы острого инфаркта миокарда, более определенно связана с появлением в последующем эктопических желудочковых ритмов, чем синусовая брадикардия, возникающая в более поздние сроки острого инфаркта миокарда. Лечение при синусовой брадикардии следует проводить в тех случаях, когда (на ее фоне) имеется выраженная эктопическая активность желудочков или когда она вызывает нарушения гемодинамики. Устранить синусовую брадикардию можно, слегка приподняв ноги больного или ножной конец кровати. Для ускорения синусового ритма лучше всего использовать атропин, вводя его внутривенно в дозе 0,4 — 0,6 мг. Если после этого сохраняется пульс менее 60 ударов в 1 мин, возможно дополнительное дробное введение атропина по 0,2 мг до тех пор, пока общая доза препарата не составит 2 мг. Стойкая брадикардия (менее 40 в 1 мин), сохраняющаяся, несмотря на введение атропина, может быть устранена с помощью электрической стимуляции. Введения изопротеренола следует избегать.
Нарушения проводимости. Нарушения проводимости могут возникнуть на трех различных уровнях проводящей системы сердца: в области предсердно-желудочкового узла, предсердно-желудочкового пучка (Гиса) или в более дистальных отделах проводящей системы (гл. 183). При появлении блокады в области предсердно-желудочкового узла, как правило, возникает замещающий ритм (escape?) предсердно-желудочкового соединения, при этом комплексы QRS обычной продолжительности. Если же блокада возникает дистально по отношению к предсердно-желудочковому узлу, замещающий ритм возникает в области желудочков, при этом комплексы QRS меняют свою конфигурацию, их продолжительность увеличивается. Нарушения проводимости могут возникнуть во всех трех периферических пучках проводящей системы, распознавание таких нарушений имеет значение для выявления больных с риском развития полной поперечной блокады. В тех случаях, когда возникает блокада любых двух из трех пучков, говорят о наличии двухпучковой блокады. У таких больных часто развивается полная атриовентрикулярная.блокада (полный поперечный блок). Таким образом, больные с комбинацией блокады правой ножки пучка Гиса и левым передним или левым задним гемиблоком или больные с вновь возникшей блокадой левой ножки пучка Гиса подвержены особенно высокому риску развития полной (поперечной) блокады.
Смертность больных с полной атриовентрикулярной блокадой, сопутствующей переднему инфаркту миокарда, составляет 80—90% и почти в 3 раза превышает смертность больных с полной атриовентрикулярной блокадой, сопутствующей нижнему инфаркту миокарда (30%). Риск смерти в последующем среди больных, выживших а острой стадии инфаркта миокарда, у первых также значительно выше. Различие в смертности объясняют тем фактом, что блокада сердца при нижнем инфаркте миокарда обычно вызвана ишемией предсердно-желудочкового узла. Предсердно-желудочковый узел — небольшая дискретная структура и даже ишемия или некроз небольшой выраженности могут вызвать его дисфункцию. При инфаркте миокарда передней стенки появление блокады сердца связано с нарушением функции всех трех пучков проводящей системы и, следовательно, является только следствием обширного некроза миокарда.
Электрическая стимуляция является эффективным средством учащения сердечного ритма у больных с брадикардией, развившейся как следствие атриовентрикулярной блокады, однако нет уверенности в том, что такое учащение пульса всегда является благоприятным. Например, у больных с инфарктом миокарда передней стенки и полной поперечной блокадой прогноз определяется главным образом размером инфаркта и коррекция дефекта проведения необязательно благоприятно повлияет на исход болезни. Электрическая стимуляция, однако, может оказаться полезной у больных с нижнезадним инфарктом миокарда, у которых полная поперечная блокада сочетается с развитием сердечной недостаточности, гипотонией, выраженной брадикардией или значительной эктопической активностью желудочков. Такие больные с инфарктом миокарда правого желудочка часто плохо реагируют на стимуляцию желудочков вследствие потери предсердного «удара», у них может потребоваться проведение двухжелудочковой, последовательной атриовентрикулярной, стимуляции.
Некоторые кардиологи считают необходимым профилактическую установку катетера для проведения стимуляции у больных с нарушениями проводимости, известными как предшественники полной (поперечной) блокады. По этому поводу единства суждений нет. Постоянную стимуляцию рекомендуют проводить больным, у которых имеется постоянная бифасцикулярная блокада и преходящая блокада III степени во время острой фазы инфаркта миокарда. Ретроспективные исследования у небольших групп таких больных показывают, что вероятность внезапной смерти снижается в тех случаях, когда проводится постоянная кардиостимуляция.
Сердечная недостаточность. Транзиторные нарушения функции левого желудочка той или иной степени возникают примерно у 50 % больных с инфарктом миокарда. Наиболее частыми клиническими признаками сердечной недостаточности являются хрипы в легких и S3 на S4-ритм галопа. На рентгенограммах часто выявляются признаки застоя в легких. Появление рентгенологических признаков легочного застоя, однако, не совпадает по времени с появлением таких клинических его признаков, как хрипы в легких и одышка. Характерными гемодинамическими признаками сердечной недостаточности служат повышение давления наполнения левого желудочка и давления в легочном стволе. Следует помнить, что эти признаки могут быть следствием ухудшения диастолической функции левого желудочка (диастолическая недостаточность) и/или уменьшения ударного объема с вторичной дилатацией сердца (систолическая недостаточность) (гл. 181). За небольшим исключением, терапия при сердечной недостаточности, сопутствующей острому инфаркту миокарда, не отличается от таковой при других заболеваниях сердца (гл. 182). Основное различие заключается в применении сердечных гликозидов. Благоприятное действие последних при остром инфаркте миокарда неубедительно. Это не удивительно, поскольку функция отделов миокарда, не захваченных инфарктом, может быть нормальной, в то же время трудно ожидать, что дигиталис может улучшить систолическую и диастолическую функции участков миокарда, захваченных инфарктом или ишемией. С другой стороны, очень хорошим действием при лечении больных с сердечной недостаточностью при инфаркте миокарда обладают диуретики, поскольку они уменьшают застой в легких при наличии систолической и/или диастолической сердечной недостаточности. Внутривенное введение фуросемида способствует снижению давления наполнения левого желудочка и уменьшению ортопноэ и одышки. Фуросемид, однако, следует назначать с осторожностью, поскольку он может вызвать массивный диурез и снизить объем плазмы, сердечный выброс, системное артериальное давление и как следствие этого уменьшить коронарную перфузию. Для уменьшения преднагрузки и симптомов застоя с успехом используют различные лекарственные формы нитратов. Изосорбида динитрат, принимаемый внутрь, или обычная мазь нитроглицерина имеют преимущество перед диуретиками, поскольку они снижают преднагрузку за счет венодилатации, не вызывая уменьшения общего объема плазмы. Кроме того, нитраты могут улучшить функцию левого желудочка за счет своего влияния на ишемию миокарда, поскольку последняя вызывает увеличение давления наполнения левого желудочка. Лечение больных с отеком легких описано в гл. 182. Изучение вазодилататоров, уменьшающих постнагрузку на сердце, показало, что ее снижение приводит к уменьшению работы сердца и вследствие этого может существенно улучшить функцию левого желудочка, снизить давление наполнения левого желудочка, уменьшить выраженность застоя в легких и в результате вызвать увеличение сердечного выброса.
Мониторирование гемодинамики. Нарушение функции левого желудочка становится гемодинамически значимым, когда возникает нарушение сократимости 20 — 25 % миокарда левого желудочка. Инфаркт, захватывающий 40 % поверхности левого желудочка и более, обычно приводит к синдрому кардиогенного шока (см. ниже). Давление заклинивания легочных капилляров и диастолическое давление в легочном стволе хорошо коррелируют с диастолическим давлением в левом желудочке, поэтому их часто используют как показатели, отражающие давление наполнения левого желудочка. Установка баллонного плавающего катетера в легочном стволе позволяет врачу постоянно следить за давлением наполнения левого желудочка. Эту методику целесообразно использовать у больных, обнаруживающих клинические признаки гемодинамических нарушений или нестабильности. Катетер, установленный в легочном стволе, позволяет определять также величину сердечного выброса. Если, кроме того, проводится мониторирование внутриартериального давления, становится возможным вычислять периферическое сосудистое сопротивление, которое помогает контролировать введение сосудосуживающих и сосудорасширяющих препаратов. У некоторых больных с острым инфарктом миокарда обнаруживается значительный подъем давления наполнения левого желудочка (> 22 мм рт. ст.) и нормальный сердечный выброс (в пределах 2,6—3,6 л/мин на 1 м2), в то время как у других имеется относительно низкое давление наполнения левого желудочка (< 15 мм рт. ст.) и сниженный сердечный выброс. У больных 1-й группы эффективным было назначение диуретиков, в то время как больные 2-й группы хорошо реагировали на увеличение объема циркулирующей жидкости, что достигалось внутривенным введением коллоидосодержащих растворов.
Кардиогенный шок — энергетическая недостаточность. С внедрением эффективных методов коррекции аритмий у больных с острым инфарктом миокарда, доставляемых в клинику, кардиогенный шок стал наиболее частым осложнением, приводящим к смерти. Он возникает примерно у 10 % таких больных и служит причной смерти примерно 60 % больных с острым инфарктом миокарда. С сожалением приходится отметить, что улучшение качества лечения никак не повлияло на смертность больных с острым инфарктом миокарда, осложнившимся кар-диогенным шоком (класс IV по Killip); она продолжает оставаться на уровне 85—95%.
Целесообразно рассматривать кардиогенный шок как форму выраженной левожелудочковой недостаточности. Этот синдром характеризуется выраженной гипотензией со снижением систолического артериального давления до величины менее 80 мм рт. ст. и значительным уменьшением сердечного индекса (< 1,8 л/мин на 1 м2) на фоне повышения давления наполнения левого желудочка (давления заклинивания легочных капилляров) более 18 мм рт. ст. Наличие только гипотензии не дает основания диагностировать кардиогенный шок, поскольку снижение систолического артериального давления до величины менее 80 мм рт. ст. в течение нескольких дней определяется у многих больных, последующее течение инфаркта миокарда у которых является вполне благоприятным. У таких больных нередко определяется сниженное давление наполнения левого желудочка и гипотензию у них обычно можно установить с помощью внутривенного введения коллоидных растворов. При кардиогенном шоке всегда имеются и другие клинические признаки неадекватного кровообращения. Следующие клинические критерии кардиогенного шока позволяют выделить группу, больных, у которых смертность составляет более 85%:1) систолическое артериальное давление составляет менее 90 мм рт. ст., при этом имелось его снижение от исходного уровня по крайней мере на 30 мм рт. ст.; 2) клинические признаки недостаточности периферического кровообращения, например похолодание конечностей, влажность кожных покровов и цианоз; 3) dulled sensorium; 4) олигурия со снижением скорости выделения мочи до 20 мл/ч; 5) отсутствие улучшения после снятия болевого синдрома и применения кислорода. Специфически исключаются больные с гипотензией, вторичной по отношению к сосудисто-вагусным реакциям, гиповолемией, аритмиями, реакциями на лекарственные препараты, сепсисом.
Патофизиология насосной недостаточности. Основной причиной кардиогенного шока при остром инфаркте миокарда служит значительное уменьшение массы сокращающегося миокарда. В патогенез кардиогенного шока в конечном счете вовлекаются все органы и системы. Функция сердца нарушается уже при первичном повреждении, это вызывает уменьшение артериального давления и, следовательно, коронарного кровотока вследствие зависимости последнего от перфузионного давления в аорте (рис. 190-2). Уменьшение коронарного перфузионного давления и миокардиального кровотока приводит к еще большему нарушению функции миокарда и может способствовать увеличению размеров инфаркта миокарда. Аритмии и ацидоз, являющиеся результатом неадекватной перфузии, также вносят вклад в этот процесс, закрепляя сложившееся патологическое состояние. Именно эта положительная обратная связь ответственна за высокий уровень смертности, сопровождающей кардиогенный шок.
Артериальное кровяное давление является функцией двух факторов — сердечного выброса и общего периферического сопротивления. Уменьшение любого из них без компенсаторного повышения другого приводит к падению артериального давления. У больных с инфарктом миокарда и шоком сердечный выброс снижен. Однако у многих больных с инфарктом миокарда без кардиогенного шока сердечный выброс снижен в такой же степени, как и у больных с кардиогенным шоком. Это свидетельствует о том, что при характеристике больных нельзя основываться только на снижении уровня сердечного выброса. Периферическое сосудистое сопротивление, другой важный фактор, определяющий уровень артериального давления, у больных с инфарктом миокарда может быть либо нормальным, либо повышенным. В норме падение сердечного выброса сопровождается компенсаторным увеличением периферического сосудистого сопротивления. Однако у больных с шоком, вызванным острым инфарктом миокарда, адекватного увеличения периферического сосудистого сопротивления может не быть. Необходимо, однако, вернуться к рассмотрению самого сердца как органа, подвергающегося наибольшему физиологическому повреждению при кардиогенном шоке.
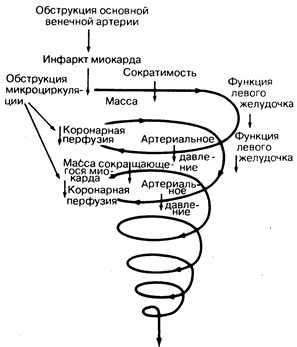
Рис. 190-2. Схема последовательности событий порочного круга, когда обструкция венечной артерии приводит к кардиогенному шоку и прогрессирующему нарушению кровообращения.
Простая схематическая диаграмма, показывающая взаимоотношение работы левого желудочка и давления наполнения, показана на рис. 190-3. Верхняя кривая представляет известное отношение Франка—Старлинга в здоровом сердце; нижняя кривая показывает зависимость, которую можно ожидать у больного с шоком, развившимся вторично вследствие инфаркта миокарда. Очевидно, что у больных с острым инфарктом миокарда при всех значениях конечно-диастолического давления работа левого желудочка существенно нарушена. В точке В конечно-диастолическое давление повышено, однако в точке Б оно может быть нормальным, несмотря на тот факт, что работа миокарда существенно снижена по сравнению с уровнем, который можно было бы ожидать при данном значении диастолического давления, что видно в точке А.
Лечение при насосной недостаточности. Больному с насосной недостаточностью необходимы при возможности постоянное мониторирование артериального давления и давления наполнения левого желудочка (о котором судят по давлению заклинивания легочных капилляров, регистрируемому с помощью баллонного катетера, установленного в легочном стволе), а также регулярное определение сердечного выброса. Всем больным с кардиогенным шоком следует назначать 100 % кислород для устранения гипоксии. При отеке легких оксигенация обеспечивается посредством эндотрахеальной интубации. Очень важно купировать боль, поскольку в ряде случаев рефлекторная вазодепрессорная активность может быть следствием выраженного болевого синдрома. Наркотики, однако, назначают с большой осторожностью вследствие их способности снижать артериальное давление.
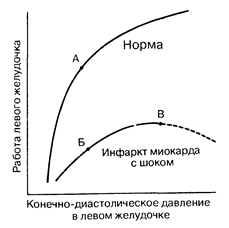
Рис. 190-3. Схематическое представление зависимости Франка—Старлинга, наблюдаемой у больных с синдромом шока во время инфаркта миокарда.
Лечение при кардиогенном шоке направлено на прерывание порочной связи (см. рис. 190-2), вследствие которой нарушение функции миокарда приводит к уменьшению артериального давления, снижению коронарного кровотока и дальнейшему ухудшению функции левого желудочка. Эта цель поддержания коронарной перфузии достигается путем повышения артериального давления с помощью вазопрессоров (см. ниже), применением внутриартериальной баллонной контрпульсации и регулированием объема крови таким образом, чтобы поддерживать оптимальный уровень давления наполнения левого желудочка (примерно 20 мм рт. ст.).
Этого можно достичь либо инфузией кристаллоидов, либо повышением диуреза. У больных со сроками инфаркта миокарда не более 4 ч реперфузия, достигающаяся с помощью тромболитической терапии и/или чрескожной транслюминальной коронароангиопластики, может значительно улучшить функцию левого желудочка.
Гиповолемия. Это легко поддающееся коррекции состояние у некоторых больных с инфарктом миокарда вносит вклад в развитие гипотензии и сосудистого коллапса. Потеря жидкости может быть следствием предшествующего лечения диуретиками, ограничения потребления жидкостей на ранних стадиях заболевания и/или рвоты, связанной с болевым синдромом или применением диуретиков. Кроме того, может наблюдаться состояние относительной гиповолемии, заключающееся в остром уменьшении сократимости левого желудочка и нарушении его функции вследствие инфаркта миокарда; в этих случаях для поддержания сердечного выброса необходимо увеличить сосудистый объем. Вследствие того что этот процесс протекает стремительно, времени для компенсаторного восстановления жидкости обычно не хватает, что приводит к развитию относительной гиповолемии у больных с нормальным объемом жидкости. У больных с острым инфарктом миокарда и гипотензией очень важно вовремя распознать гиповолемию и скорректировать ее, не прибегая к более сильнодействующим средствам, использующимся обычно для лечения по поводу гипотензии. Если давление наполнения левого желудочка сохраняется в пределах нормы, жидкость следует вводить до тех пор, пока не удастся добиться максимального увеличения сердечного выброса. Последнее, как правило, достигается при значениях давления наполнения левого желудочка, равных примерно 20 мм рт. ст.
Оптимальный уровень давления наполнения левого желудочка имеет давление заклинивания легочного ствола, однако может существенно варьировать у разных больных. Идеальный уровень давления у каждого больного достигается с помощью очень аккуратного введения жидкости под тщательным постоянным контролем за оксигенацией и сердечным выбросом. При достижении плато сердечного выброса (см. рис. 190-3, В) дальнейшее увеличение давления наполнения левого желудочка будет лишь увеличивать признаки застоя и уменьшать общую оксигенацию. Центральное венозное давление отражает скорее давление наполнения правого желудочка, чем левого желудочка. Нет необходимости регистрировать его в данной ситуации, поскольку функция левого желудочка при остром инфаркте миокарда почти всегда нарушается в большей степени, чем функция правого желудочка.
Вазопрессорные npeпараты. Существует множество препаратов для внутривенного введения, которые можно использовать для повышения артериального давления и сердечного выброса у больных с кардиогенным шоком. К сожалению, при их использовании возникает множество проблем; ни один из этих препаратов не способен повлиять на исход заболевания у лиц с установленным кардиогенным шоком. Изопротеренол, синтетический симпатомиметический амин, в настоящее время редко используется для лечения больных с шоком при инфаркте миокарда. Хотя этот препарат увеличивает сократимость миокарда, он одновременно вызывает периферическую вазодилатацию и увеличение частоты сердечных сокращений. В результате его действия увеличивается потребность миокарда в кислороде и уменьшается коронарная перфузия, что может привести к расширению зоны ишемического повреждения. Норадреналин является потенциальным -адренергическим препаратом, имеющим мощное сосудосуживающее действие. Он также обладает адренергической активностью и поэтому может увеличивать сократимость. Норадреналин эффективно повышает артериальное давление. Однако он вызывает увеличение постнагрузки, кроме того, увеличение сократимости, наблюдающееся при его применении, способствует значительному повышению потребности миокарда в кислороде. Этот препарат целесообразно использовать в критических (безнадежных) ситуациях. Его также можно применять у больных с кардиогенным шоком и сниженным периферическим сопротивлением сосудов. Норадреналин следует назначать в минимально возможных дозах (начинать инфузию со скорости 2—4 мкг/мин), необходимых для поддержания артериального давления на уровне 90 мм -рт. ст. Если артериальное давление не удается поддерживать на заданном уровне при введении норадреналина. в дозе 15 мкг/мин, вероятность того, что большие дозы препарата дадут эффект, очень мала.
Допамин (дофамин) (гл. 66) весьма эффективен у многих больных с недостаточностью сократительной функции сердца. В малых дозах (2—10 мкг/кг в 1 мин) препарат обладает положительным хронотропным и инотропным действием, которое является следствием стимуляции рецепторов. В больших дозах проявляется вазоконстрикторное действие препарата, являющееся результатом стимуляции -рецепторов. В очень низких дозах (< 2 мкг/кг в 1 мин) допамин обладает уникальной способностью расширять сосуды почек и селезенки, при этом оказывать незначительное влияние на потребление кислорода миокардом. Внутривенное введение допамина начинают со скоростью 2—5 мкг/кг в 1 мин, увеличивая дозу каждые 2—5 мин, до достижения максимальной дозы в 20— 50 мкг/кг в 1 мин. При этом систолическое артериальное давление следует поддерживать на уровне 90 мм рт. ст. Добутамин является синтетическим симпатомиметическим амином, обладающим при применении обычных доз (2,5 — 10 мкг/кг в 1 мин) минимальным положительным инотропным и периферическим сосудосуживающим действием. Его не следует использовать в тех случаях, когда желательно добиться сосудосуживающего эффекта. У больных с не столь выраженной степенью гипотензии добутамин может оказаться полезным, особенно тогда, когда нежелятельно получать положительное хронотропное действие.
Амринон (Amrinone) — препарат с положительным инотропным действием отличным по структуре и действию от катехоламинов. По фармакологической активности он напоминает добутамин, хотя его вазодилатирующее действие выражено в большей степени, чем у последнего. Вначале вводится нагрузочная доза в 0,75 мг/кг. Если после этого достигается желаемый эффект, то затем проводится инфузия препарата со скоростью 10 мкг/кг в 1 мин, при необходимости через 30 мин вводят дополнительный болюс в 0,75 мг/кг.
Если причиной недостаточности левого желудочка и выраженной гипотензии служит глобальная ишемия, как это, например, имеет место у больных с критическим стенозом основного ствола левой венечной артерии, то благоприятного эффекта можно достичь с помощью кратковременного введения чистых вазоконстрикторов, а не препаратов, обладающих положительным инотропным действием. В таких случаях улучшения коронарной перфузии можно добиться за счет повышения АД с помощью вазоконстрикторов. В то же время препараты, обладающие положительным инотропным действием, могут лишь увеличить степень ишемического повреждения миокарда, который уже не способен к дальнейшему увеличению выполняемой работы. В таких случаях, когда в качестве вазоконстриктора назначают неосинефрин (Neosynephrine) в дозе 10—100 мкг/мин, лечение должно быть как можно менее продолжительным, его следует рассматривать в качестве предварительной терапии, во время которой проводится подготовка к интрааортальной баллонной контрпульсации и/или к неотложному хирургическому вмешательству на венечных артериях.
Сердечные гликозиды (гл. .182). Подтверждение о главенствующей роли нарушения функции миокарда в патогенезе кардиогенного шока заставляет предположить, что применение сердечных гликозидов окажется достаточно эффективным методом лечения при этом состоянии. Контролируемые исследования, однако, не смогли продемонстрировать благоприятного действия сердечных гликозидов на ранних стадиях (0 — 48 ч) острого инфаркта миокарда. Улучшение гемодинамики можно было наблюдать лишь в более поздних стадиях, однако и тогда этот эффект был незначительным. Поскольку сердечные гликозиды не способны улучшать функцию некротизированного миокарда, а степень насосной недостаточности, вероятно, прямо связана с общей массой миокарда, подвергшейся инфаркту, применение дигиталиса не приводит к существенному улучшению состояния больных с острым инфарктом миокарда. Тем не менее назначение дигиталиса может быть оправдано у больных с признаками левожелудочковой недостаточности. Было продемонстрировано, что при достаточно тщательном подборе дозы сердечных гликозидов риск появления аритмий и разрыва миокарда у больных с острым инфарктом миокарда, получающих сердечные гликозиды, не выше, чем в контрольной группе. Поэтому назначение дигиталиса относительно безопасно.
Аортальная контрпульсация. Основным проявлением шока при остром инфаркте миокарда является нарушение функции миокарда. Поэтому для поддержания насосной функции сердца во время кардиогенного шока были разработаны соответствующие приспособления. Наибольший опыт использования в клинике накоплен при применении внутриаортальной баллонной системы для повышения диастолического АД. Баллон, имеющий форму колбаски, с катетером на конце проводят в аорту через бедренную артерию. Баллон надувают в стадии ранней диастолы, усиливая таким образом коронарный кровоток и периферическую перфузию. Баллон спадается в фазу ранней систолы, уменьшая таким образом постнагрузку, против которой совершает работу левый желудочек. У значительной части больных при проведении этой процедуры наблюдается улучшение гемодинамики, однако долговременный прогноз все же остается неблагоприятным. Систему для проведения баллонной контрпульсации лучше всего сохранять для тех больных, состояние которых требует хирургического вмешательства (при сохраняющейся ишемии, разрыве межжелудочковой перегородки, митральной регургитации), а также для больных, у которых успешное хирургическое лечение с большей вероятностью приведет к устранению кардиогенного шока.
К сожалению, есть основания полагать, что результаты лечения при шоке, развившемся вторично вследствие инфаркта миокарда, несмотря на постепенное их улучшение благодаря особому вниманию к деталям терапии, описанным выше, в целом все же будут оставаться достаточно неблагоприятными потому, что у большинства больных с этим синдромом следствием диффузного коронарного атеросклероза является поражение значительной части миокарда. Несмотря на отдельные случаи значительного улучшения состояния больных, достигнутого в результате только экстренной хирургической реваскуляризации или экстренной реваскуляризации в комбинации с инфарктэктомией, результаты такого подхода оказались в целом разочаровывающими. Можно надеется, что своевременно начатая тромболитическая терапия сможет уменьшить объем подвергающегося некрозу миокарда и тем самым уменьшить вероятность развития кардиогенного шока.
Другие осложнения. Митральная регургитация. Систолический шум митральной регургитации в области верхушки в первые пять дней после начала острого инфаркта миокарда выслушивается более чем у 25 % больных, однако гемодинамически значительная митральная регургитация имеется лишь у незначительной части. У большинства больных систолический шум регистрируется лишь в острой стадии инфаркта миокарда и исчезает впоследствии. Чаще всего митральную регургитацию после инфаркта миокарда вызывает дисфункция сосочковых мышц левого желудочка вследствие их инфаркта или ишемии.
Митральная регургитация может также быть результатом изменения размеров или формы левого желудочка вследствие нарушения его сократимости или образования аневризмы. Может наблюдаться также разрыв сосочковых мышц, причем задняя сосочковая мышца подвергается разрыву вдвое чаще, чем передняя. При возникновении митральной регургитации на фоне острого инфаркта миокарда функция левого желудочка может ухудшаться очень значительно. Митральную регургитацию следует дифференцировать от перфорации межжелудочковой перегородки (см. ниже), причем это удобнее всего делать непосредственно у постели больного с помощью плавающего баллонного катетера. У больных с гемодинамически значимой митральной регургитацией при регистрации давления заклинивания легочных капилляров могут выявляться большие V-волны, при этом отсутствует так называемое кислородное повышение при перемещении катетера из правого предсердия в правый желудочек. Хирургическая замена митрального клапана может привести к значительному улучшению состояния больных, у которых острая сердечная недостаточность является в первую очередь следствием выраженной митральной регургитации в результате разрыва сосочковых мышц или их дисфункции, а функция миокарда относительно сохранена.
При снижении систолического давления в аорте у больного с митральной регургитацией значительная часть ударного объема левого желудочка выбрасывается антеградно, что приводит к уменьшению фракции регургитации. Поэтому как внутриаортальная баллонная контрпульсация, механически снижающая систолическое давление в аорте, так и инфузия натрия нитропруссида в дозе 0,5 — 8,0 мкг/кг в 1 мин, снижающая периферическое сосудистое сопротивление, могут использоваться в качестве начальной терапии больных с выраженной митральной регургитацией, сопровождающей острый инфаркт миокарда. В идеальном случае радикальное хирургическое вмешательство должно быть отложено на 4 — 6 нед после инфаркта миокарда. Однако, если состояние гемодинамики и/или клиническое состояние больного не улучшаются и не стабилизируются, хирургическое вмешательство нельзя откладывать даже в острой стадии инфаркта миокарда.
Разрыв сердца. Разрыв сердца является серьезнейшим осложнением инфаркта миокарда, возникающим, как правило, во время 1-й недели с момента проявления заболевания. Частота этого осложнения увеличивается с возрастом больных. Разрыв миокарда чаще происходит при первом инфаркте миокарда у женщин, а также у больных с сопутствующей артериальной гипертензией. Клинические проявления разрыва сердца заключаются во внезапном исчезновении пульса и АД, потере сознания, при этом на ЭКГ продолжает регистрироваться синусовый ритм (фактическая электромеханическая диссоциация). Миокард продолжает сокращаться, однако изгнания крови из сердца не происходит вследствие того, что кровь попадает в перикард. Развивается тампонада сердца (гл. 194), при этом прямой массаж сердца неэффективен. Разрыв сердца почти всегда заканчивается смертью больного. Известно лишь несколько случаев, когда это состояние было своевременно диагностировано и больные успешно вылечены с помощью перикардиоцентеза и экстренного хирургического вмешательства.
Разрыв перегородки. Патогенез перфорации межжелудочковой перегородки аналогичен таковому при разрыве миокарда, однако возможности терапии при этом состоянии более обширные. Разрыв межжелудочковой перегородки обычно проявляется выраженной сердечной недостаточностью, сочетающейся с внезапно появляющимся пансистолическим шумом, часто сопровождающимся парастернальным дрожанием. Это состояние часто невозможно отличить от состояния, наблюдающегося при разрыве сосочковых мышц и возникающей вследствие этого митральной регургитации. Наличие высокой волны V при регистрации давления заклинивания легочных капилляров, наблюдающееся при обоих состояниях, еще более осложняет дифференциальную диагностику. Диагноз разрыва межжелудочковой перегородки может быть установлен с помощью демонстрации шунта «слева направо» (т. е. при наличии кислородного повышения на уровне правого .желудочка) при ограниченной катетеризации сердца, выполненной у постели больного с помощью плавающего баллонного катетера. Больные с разрывом межжелудочковой перегородки требуют срочного хирургического лечения. Хотя последнее и сопряжено с высоким риском летального исхода, его обычно применяют для лечения больных, состояние которых не удалось быстро стабилизировать. Длительный период нарушенной гемодинамики может привести к повреждению органов и ряду осложнений, которых можно избежать с помощью безотлагательного вмешательства, включающего введение нитропруссида натрия и интрааортальную баллонную контрпульсацию. Если состояние больного стабилизировалось, хирургическое вмешательство может быть отложено на 4 — 8 нед для того, чтобы дать возможность образоваться рубцовой ткани по краям дефекта, что облегчает хирургическую коррекцию. Тем не менее смертность при перфорации межжелудочковой перегородки напрямую связана с общей площадью повреждения миокарда, а не со сроками хирургического вмешательства.
Физиологические особенности острой митральной регургитации и острой перфорации межжелудочковой перегородки сходны в плане того, что уровень систолического давления в аорте отчасти определяет объем регургитации. Принципиальное различие между этими состояниями заключается в том, что изгнание регургитирующего объема крови происходит в разные камеры. При перфорации межжелудочковой перегородки часть ударного объема левого желудочка выбрасывается в правый желудочек. Поэтому, как и при митральной регургитации, снижение систолического давления в аорте с помощью механических (интрааортальная баллонная контрпульсация) и/или фармакологических (введение нитроглицерина или нитропруссида натрия) средств может уменьшить, степень нарушения гемодинамики, вызванной перфорацией.
Аневризма желудочка. Термин «аневризма желудочка» обычно употребляется для обозначения дискинезии или парадоксального движения локально расширенной стенки миокарда. Степень укорочения нормально функционирующих волокон миокарда при развитии аневризмы должна увеличиваться для поддержания ударного выброса и минутного объема. Если этого не происходит, общая функция левого желудочка нарушается. Аневризмы состоят из рубцовой ткани, поэтому их существование не предрасполагает к разрыву сердца и не свидетельствует о повышенном риске разрыва сердца.
Осложнения аневризмы левого желудочка обычно не возникают в течение первых недель или месяцев после инфаркта миокарда. Эти осложнения включают застойную сердечную недостаточность, артериальную эмболию, желудочковые аритмии. Чаще всего встречаются и легче всего распознаются аневризмы верхушки левого желудочка. Наиболее достоверным физикальным признаком аневризмы является двойной, диффузный или смещенный верхушечный толчок. На стандартной рентгенограмме часто выставляют выступающее искривление левой границы сердца, однако рентгенограмма может быть и не изменена, особенно при аневризме задней стенки левого желудочка. На ЭКГ в покое у 25 % больных с аневризмой верхушки или передней стенки выявляется подъем сегмента ST в прекордиальных отведениях. Аневризмы левого желудочка хорошо выявляются с помощью секторальной эхокардиографии. Последняя позволяет обнаружить также пристеночный тромб в стенке аневризмы, захватывающий переднюю стенку левого желудочка или его верхушку. Аневризмы левого желудочка могут быть причиной продолжительной желудочковой тахикардии. Подобным больным требуется лечение антиаритмическими препаратами или резекция эндокарда (гл. 184).
Инфаркт правого желудочка. Примерно у 1/3 больных с нижнезадними инфарктами миокарда обнаруживается некроз правого желудочка (хотя бы незначительный). Иногда у больных с нижнезадним инфарктом миокарда левого желудочка выявляют обширный инфаркт миокарда правого желудочка. V таких больных обычно имеются признаки выраженной правожелудочковой недостаточности (набухание яремных вен, гепатомегалия) с гипотензией или без нее. У большинства больных с инфарктом миокарда правого желудочка наблюдают подъем сегмента ST в правых грудных отведениях, особенно в отведении V4R. Радионуклидная вентрикулография и секторальная эхокардиограмма с достаточной степенью чувствительности выявляют поражение правого желудочка, связанного с его инфарктом. При катетеризации правых отделов сердца чаще выявляют гемодинамические признаки, напоминающие тампонаду сердца или констриктивный перикардит (гл. 194). Меры, направленные на увеличение объема циркулирующей крови, часто приносят успех при лечении больных с низким сердечным выбросом и гипотензией, связанными с обширным инфарктом миокарда правого желудочка.
Тромбоэмболия. Клинически значимая тромбоэмболия осложняет инфаркты миокарда примерно у 10 % больных, однако эмболические повреждения при некропсии находят у 45 % больных, что свидетельствует о том, что тромбоэмболия часто протекает бессимптомно. Считается, что тромбоэмболия вносит существенный вклад в механизм смерти у 25 % больных с инфарктом миокарда, погибающих во время пребывания в клинике. Источником артериальных эмболов обычно являются пристеночные тромбы в левом желудочке, большинство венозных эмболов происходит из вен нижних конечностей. Тромбоэмболия чаще возникает у больных с обширным инфарктом миокарда, осложненным сердечной недостаточностью. У больных с эхокардиографическими признаками тромбоза в левом желудочке тромбоэмболия, возникает очень часто; вместе с тем у больных с отсутствием таких признаков тромбоэмболия — редкое осложнение. Частота тромбоэмболии, по-видимому, может быть снижена применением антикоагулянтов, хотя это не подтверждено хорошо контролируемыми исследованиями.
Перикардиты (см. также гл. 194). Шум трения перикарда и перикардиальная боль часто встречаются у больных с острым инфарктом миокарда. При этом осложнении больные поддаются лечению аспирином (650 мг 3 раза в день). Важно диагностировать, что боль в грудной клетке связана именно с перикардитом, поскольку ошибки в интерпретации такой боли могут привести к неправильному суждению о наличии повторной ишемии миокарда и/или распространении инфаркта миокарда и неадекватному назначению антикоагулянтов, нитратов, адреноблокаторов, наркотиков. Четкой связи и зависимости между применением антикоагулянтов и развитием тампонады сердца или перикардита не выявлено. Тем не менее вероятность того, что введение антикоагулянтов при остром перикардите может вызвать тампонаду сердца, достаточно высока. Поэтому антикоагулянты считаются противопоказанными больным с перикардитом, проявляющимся либо наличием постоянной боли, либо шумом трения перикарда, если только не существует особых причин к их назначению.
Постинфарктный синдром Дресслера (см. также гл. 194). Развитие этого синдрома, характеризующегося лихорадкой и плевроперикардиальной болью в грудной клетке, связывают с наличием аутоиммунного перикардита, плеврита и/или пневмонита. Признаки его появляются в течение от нескольких дней до 6 нед после начала острого инфаркта миокарда. Возникновение синдрома Дресслера может быть этиологически связано с ранним применением антикоагулянтов. Частота его развития существенно снижается в последние десятилетия благодаря значительно более редкому назначению антикоагулянтов при остром инфаркте миокарда. Больные хорошо реагируют на лечение салицилатами. В редких случаях может потребоваться назначение кортикостероидов для снятия значительно выраженного, рефрактерного к лечению, болевого синдрома. В случае назначения антикоагулянтов выпот, появляющийся в полости перикарда при синдроме Дресслера, может принимать геморрагический характер.
Дата добавления: 2015-07-22; просмотров: 1583;
