Химические св-ва. Амины более сильные основания, чем NH3
I. Оснóвные св-ва
Амины более сильные основания, чем NH3. Это объясняется + I эффектом радикалов. Чем больше электронная плотность на атоме N, тем больше основность. Вторичные амины более сильные основания, чем первичные. Основность третичных аминов уменьшается, что объясняется экранирующим влиянием атома N тремя алкильными группами.
Поскольку ЭО атома N меньше ЭО атома О, амины образуют менее прочные ассоциаты, чем соответствующие спирты и имеют более низкие температуры кипения. Температура кипения этанола 78 оС, а этиламина – 17 оС.
При растворении в воде к аминам присоединяется Н+ от молекулы НОН, поэтому растворы аминов имеют щелочную р-цию:
СН3 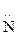 H2 + HOH ® [СН3
H2 + HOH ® [СН3  H3]OH-
H3]OH-
Гидроксидметиламмония
При действии к-т образуются соли:
СН3 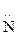 H2 + HС1 ® [СН3
H2 + HС1 ® [СН3  H3]Сl-
H3]Сl-
Хлоридметиламмония
Щелочи разлагают соли аминов и выделяют свободные амины:
[СН3  H3]Сl- + NaOH ® NaCl + CH3NH2 + H2O
H3]Сl- + NaOH ® NaCl + CH3NH2 + H2O
Особенно сильные оснóвные св-ва у чертвертичных аммониевых оснований, которые по силе соответствуют щелочам:
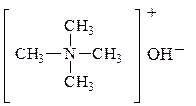
Оснóвные св-ва ароматических аминов ослаблены за счет р,p-сопряжения NH2 – группы с бензольным кольцом. Поэтому анилин образует соли только с сильными минеральными к-тами. Водный р-р анилина не изменяет окраску индикаторов.
II. Р-ции алкилирования и ацилирования
В этом случае амины проявляют нуклеофильные св-ва за счет электронной пары атома азота.
1)
|
|
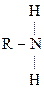 : ××××××××>
: ××××××××> 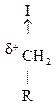 ®
® 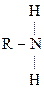 : ×××
: ××× 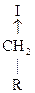
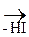 R – NH – CH2R
R – NH – CH2R
Аналогично идет образование третичных и четвертичных аминов.
2)
|
|
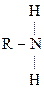 : ××××××××> d+
: ××××××××> d+ 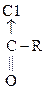 ®
® 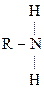 : ×××
: ××× 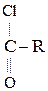
 R – NH –
R – NH – 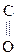 – R
– R
Подобным образом алкилируется и ацилируется С6Н5NH2.
III. Р-ция с альдегидом
R – NH2 + O =  – R
– R 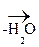 R – N =
R – N =  – R
– R
|
IV. Качественные р-ции на амины (р-ция с HNO2)
1)
|
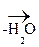 [R – N= N – OH]
[R – N= N – OH] 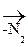 ROH
ROH
2) 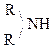 + HONO
+ HONO 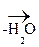
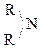 -NO¯
-NO¯
Желтый
Нитрозоамины
Нитрозоамины являются канцерогенными веществами. Нитраты в организме восстанавливаются до нитритов.
3) R3N: + НNO2 ® [R3NH]+NO2-
Соль
При действии HNO2 на соли анилина образуется не фенол, а соли диазония (широко используемые в химии красителей), которые при нагревании выделяют азот N2 с образованием фенола:
[С6Н5  H3]Cl- + HONO ® [С6Н5
H3]Cl- + HONO ® [С6Н5  ºN]Cl- + 2Н2О
ºN]Cl- + 2Н2О
Соль диазония
[С6Н5  ºN]Cl- + 2Н2О
ºN]Cl- + 2Н2О 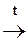 N2 + HCl + С6Н5OH
N2 + HCl + С6Н5OH
V. Р-ции по радикалу
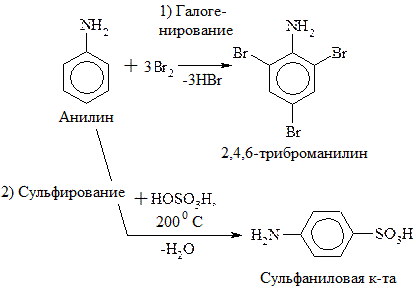
Сульфаниловая к-та – важный продукт в синтезе лекарственных веществ (сульфаниламидных препаратов) и красителей.
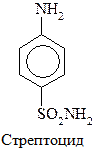 Наибольшую активность имеют производные сульфаниламидов, в которых атом Н в группе – SO2NH2 замещен на гетероцикл. Например, сульфадиметоксин:
Наибольшую активность имеют производные сульфаниламидов, в которых атом Н в группе – SO2NH2 замещен на гетероцикл. Например, сульфадиметоксин:
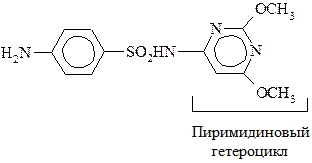
Сульфаниламиды, являясь антиметаболитами n-аминобензойной к-ты (ПАБК), блокируют биосинтез фолиевой к-ты (витамин Вс), необходимой для нормального развития и размножения микроорганизмов. Сульфаниламиды имеют сходные геометрические параметры с ПАБК, что позволяет им встраиваться вместо последней в синтез фолиевой к-ты.
Дата добавления: 2015-07-22; просмотров: 920;
