Химические св-ва
I. Кислотно-оснóвные
Cпирты – слабые амфотерные соединения.
2R–ОН + 2Nа ® 2R–ОNа + Н2
Алкоголят
натрия
Алкоголяты легко гидролизуются, что показывает – спирты более слабые кислоты, чем вода:
R– ОNа + НОН ® R–ОН + NаОН
Оснóвный центр в спиртах – гетероатом О:
|
|
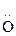 Н +
Н + 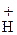 Сl- ® [СН3-СН2-
Сl- ® [СН3-СН2- 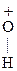 -Н]Сl-
-Н]Сl-
Этилоксонийхлорид
II. Реакции SN по гр. –ОН
Гр. -ОН является плохоуходящей группой (связь мало полярна), поэтому большинство р-ций проводят в кислой среде. Механизм р-ции:
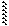
|
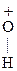 -Н ® СН3-СН2+ + Н2О
-Н ® СН3-СН2+ + Н2О
Если р-ция идет с галогеноводородами, то присоединяться будет галогенид-ион: СН3-СН2+ + Сl- ® СН3-СН2Сl
НС1 RОН R-СООН NН3 С6Н5ОNа
¯ ¯ ¯ ¯ ¯
С1- R-О- R-СОО- NН2- С6Н5О-

Анионы в таких р-циях выступают в качестве нуклеофилов (Nu) за счет «-» заряда или неподеленной электронной пары. Анионы являются более сильными основаниями и нуклеофильными реагентами, чем сами спирты. Поэтому на практике для получения простых и сложных эфиров используются –алкоголяты, а не сами спирты. Если нуклеофилом является другая молекула спирта, то она присоединяется к карбокатиону:
|
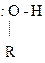 ® СН3-СН2+ -
® СН3-СН2+ - 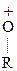 - Н
- Н 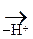 СН3-СН2-О-R
СН3-СН2-О-R
Это р-ция алкилирования (введение алкила R в молекулу).
Заместить –ОН гр. на галоген можно при действии РСl3, РСl5 и SОСl2.
По такому механизму легче реагируют третичные спирты.
Р-цией SЕ по отношению к молекуле спирта является р-ция образования сложных эфиров с органическими и минеральными к-тами:
 R – О Н + Н О –
R – О Н + Н О – 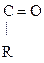
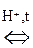 R – О –
R – О – 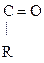 + Н2О
+ Н2О
Сложный эфир
Это р-ция ацилирования – введение ацила в молекулу.
|
 R -
R - 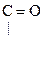
Азотная Сложный
к-та эфир
III. Р-ции Е (отщепления, или элиминирования)
Эти р-ции конкурируют с реакциями SN.
|
|
 СН3-СН2-
СН3-СН2- 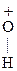 -Н
-Н 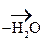 СН3-СН2+
СН3-СН2+
При избытке Н2SО4 и более высокой температуре, чем в случае р-ции образования простых эфиров, идет регенерация катализатора и образуется алкен:
СН3-СН2+ + НSО4- ® СН2 = СН2 + Н2SО4
Легче идет р-ция Е для третичных спиртов, труднее для вторичных и первичных, т.к. в последних случаях образуется менее стабильные катионы. В данных р-циях выполняется правило А. Зайцева: «При дегидратации спиртов атом Н отщепляется от соседнего атома С с меньшим содержанием атомов Н».
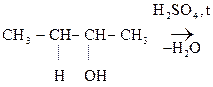 СН3-СН = СН -СН3
СН3-СН = СН -СН3
Бутанол-2
В организме гр. –ОН превращается в легкоуходящую путем образования эфиров с Н3РО4:
|
|
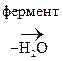 СН3-СН2-ОРО3Н2
СН3-СН2-ОРО3Н2
IV. Р-ции окисления
 1) Первичные и вторичные спирты окисляются СuО, растворами КМnО4, К2Сr2О7 при нагревании с образованием соответствующих карбонилсодержащих соединений:
1) Первичные и вторичные спирты окисляются СuО, растворами КМnО4, К2Сr2О7 при нагревании с образованием соответствующих карбонилсодержащих соединений:


|
|
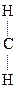 -ОН + О
-ОН + О  СН3-CH2-
СН3-CH2- 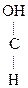 -ОН
-ОН 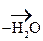 СН3-СН2-
СН3-СН2-  -Н
-Н



|
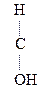 - СН3 + О
- СН3 + О  СН3-
СН3- 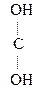 - СН3
- СН3 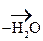 СН3-
СН3- 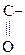 СН3
СН3
Ацетон (кетон)
2) Третичные спирты окисляются с трудом.
К реакциям окисления относятся и р-ции дегидрирования:
|
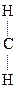 - ОН
- ОН 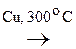 СН3 -
СН3 - 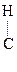 = О + Н2
= О + Н2
Этанол
V. По радикалу (R) протекают р-ции, характерные для соответствующих углеводородов (УВ). В случае предельных – SR, непредельных – АN, ароматических – SЕ:
СН3-СН2-ОН + 3Вr2  СВr3-СН2-ОН + 3НВr
СВr3-СН2-ОН + 3НВr
Этанол Нарколан
СН2 = СН-СН2-ОН + Вr2  СН2 Вr–СНВr–СН2ОН
СН2 Вr–СНВr–СН2ОН
Аллиловый спирт 2,3-Дибромпропанол
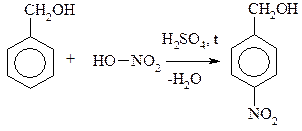
Бензиловый спирт n-Нитрофенилметанол
Дата добавления: 2015-07-22; просмотров: 1159;
