Кислотность и основность
Для характеристики кислотности и основности органических соединений применяют теорию Бренстеда. Основные положения этой теории:
1) Кислота – это частица, отдающая протон (донор Н+); основание – это частица, принимающая протон (акцептор Н+).
2) Кислотность всегда характеризуется в присутствии оснований и наоборот.
Примеры:
А – Н + : В Û А– + В – Н+
К-та Осн-ие Сопряженное Сопряженная
осн-ие к-та
СН3СООН + НОН Û СН3СОО– + Н3О+
К-та Осн-ие Сопряженное Сопряженная
осн-ие к-та
НNО3 + СН3СООH Û СН3СООН2+ + NО3-
К-та Осн-ие Сопряженная Сопряженное
к-та осн-ие
Кислоты Бренстеда
3) К-ты Бренстеда делятся на 4 вида в зависимости от кислотного центра:
 - SН к-ты (тиолы),
- SН к-ты (тиолы),
- ОН к-ты (спирты, фенолы, карбоновые к-ты),
- NН к-ты (амины, амиды),
- СН к-ты (УВ).
В этом ряду сверху вниз кислотность уменьшается.
4) Сила к-ты определяется стабильностью образующегося аниона. Чем стабильнее анион, тем сильнее к-та. Стабильность аниона зависит от делокализации (распределения) «-» заряда по всей частице (аниону). Чем больше делокализован «-» заряд, тем стабильнее анион и сильнее к-та.
Делокализация заряда зависит:
a) от электроотрицательности (ЭО) гетероатома. Чем больше ЭО гетероатома, тем сильнее соответствующая к-та.
Например: R – ОН и R – NН2
Спирты более сильные к-ты, чем амины, т.к. ЭО (О) > ЭО (N).
б) от поляризуемости гетероатома. Чем больше поляризуемость гетероатома, тем сильнее соответствующая к-та.
Например: R – SН и R – ОН
Тиолы более сильные к-ты, чем спирты, т.к. атом S более поляризован, чем атом О.
в) от характера заместителя R (длины его, наличие сопряженной системы, делокализации электронной плотности).
Например: СН3 – ОН, СН3 – СН2 – ОН, СН3 – СН2 – СН2 – ОН
 Кислотность <, т.к. увеличивается длина радикала
Кислотность <, т.к. увеличивается длина радикала
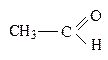 При одинаковом кислотном центре сила спиртов, фенолов и карбоновых к-т не одинакова. Например,
При одинаковом кислотном центре сила спиртов, фенолов и карбоновых к-т не одинакова. Например,
СН3 – ОН, С6Н5 – ОН,

Сила к-ты увеличивается
Фенолы являются более сильными к-тами, чем спирты за счет р, p-сопряжения (+М) группы –ОН.
 Связь О–Н более поляризуется в фенолах. Фенолы могут взаимодействовать даже с солями (FеС13) – качественная реакция на фенолы. Карбоновые
Связь О–Н более поляризуется в фенолах. Фенолы могут взаимодействовать даже с солями (FеС13) – качественная реакция на фенолы. Карбоновые
к-ты по сравнению со спиртами, содержащими одинаковый R, являются более сильными к-тами, т.к. связь О–Н значительно поляризована за счет –М эффекта группы > С = О:
Кроме того карбоксилат-анион более стабилен, чем анион спирта за счет р,p-сопряжения в карбоксильной группе.
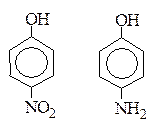 г) от введения заместителей в радикал. ЭА заместители увеличивают кислотность, ЭД заместители уменьшают кислотность.
г) от введения заместителей в радикал. ЭА заместители увеличивают кислотность, ЭД заместители уменьшают кислотность.
Например:
р-Нитрофенол более сильная к-та, чем р-аминофенол, т.к. группа –NО2 является ЭА.
СН3–СООН ССl3–СООН
рК 4,7 рК 0,65
Трихлоруксусная к-та во много раз сильнее СН3СООН за счет – I атомов Сl как ЭА.
Муравьиная к-та Н–СООН сильнее СН3СООН за счет +I группы СН3– уксусной к-ты.
д) от характера растворителя.
Если растворитель является хорошим акцептором протонов Н+, то сила
к-ты увеличивается и наоборот.
Дата добавления: 2015-07-22; просмотров: 1946;
