Кристаллическое состояние вещества
Свойства твёрдых веществ определяются природой частиц, занимающих узлы кристаллической решетки и типом химической связи между ними.
Кристаллы – это физические тела, частицы которых образуют кристаллическую решетку, обладают симметрией атомной структуры, имеют определённую форму и объём, и индивидуальные температуры плавления.
В зависимости от природы частиц кристалла различают ионные, атомные, молекулярные и металлические решетки (рисунок 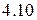 ).
).
Большая часть веществ, которые при комнатной температуре находятся в жидком или газообразном состоянии, при низких (отрицательных) температурах образуют атомные (благородные газы) и молекулярные ( 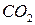 ,
, 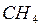 , и др.) кристаллы, поскольку силы между атомами и молекулами в таких кристаллах относятся к слабым межмолекулярным связям. Хотя энергия этих молекулярных сил даже меньше водородной связи и составляет
, и др.) кристаллы, поскольку силы между атомами и молекулами в таких кристаллах относятся к слабым межмолекулярным связям. Хотя энергия этих молекулярных сил даже меньше водородной связи и составляет 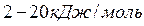 , они носят универсальный характер и проявляются во всех веществах в любом агрегатном состоянии.
, они носят универсальный характер и проявляются во всех веществах в любом агрегатном состоянии.
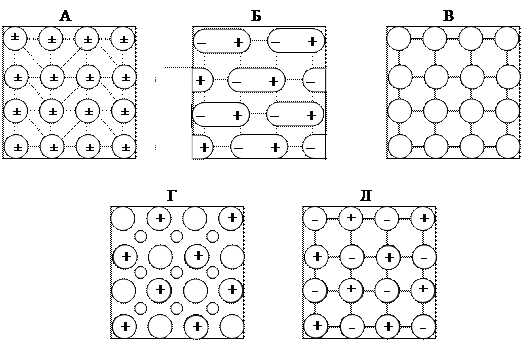 |
Рисунок 4.10 – Типы кристаллических решеток (схема). Молекулярные, состоящие из неполярных
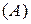 и полярных
и полярных 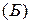 молекул; атомная
молекул; атомная 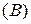 , металлическая
, металлическая 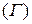 , ионная
, ионная 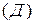 решетки
решетки
Важной характеристикой кристаллических веществ является координационное число, определяемое в кристаллохимии как число ближайших соседних частиц, которые вплотную примыкают к данной частице или молекуле. Например, в кристалле 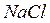 координационные числа
координационные числа  ионов
ионов 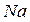 и
и  равны
равны 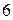 .
.
Твердые вещества могут находиться не только в кристаллическом состоянии, но и в аморфном. Для аморфного состояния характерными признаками являются следующие: ближняя упорядоченность, т.е. локальная структура около выделенной частицы, отсутствие кристаллической структуры, т.е. дальнего порядка, отсутствие определённой температуры плавления, изотропность физико-химических свойств, т.е. изменение свойств во всех направлениях происходит одинаково.
Дата добавления: 2015-07-18; просмотров: 718;
