Типы ковалентных связей
Во многих молекулах реализуются так называемые 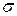 (сигма) – и
(сигма) – и 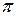 (пи) – связи.
(пи) – связи.
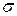 - связь – перекрытие электронных облаков атомов происходит вдоль линии, соединяющей ядра атомов.
- связь – перекрытие электронных облаков атомов происходит вдоль линии, соединяющей ядра атомов.
s - s s – p p – p s - d
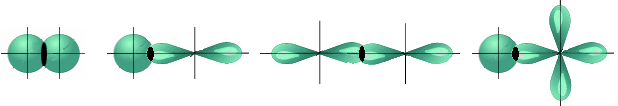
Рисунок 4.4 - Примеры образования s - связи
Одинарные (простые) связи всегда являются s-связями.
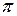 -связи – перекрытие электронных облаков взаимодействующих атомов происходит в двух областях выше и ниже узловой плоскости.
-связи – перекрытие электронных облаков взаимодействующих атомов происходит в двух областях выше и ниже узловой плоскости.
p – p p - d
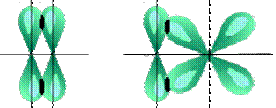
Рисунок 4.5 - Примеры образования 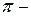 связи
связи
Узловая плоскость – это плоскость, в которой электронная плотность равна нулю. Несмотря на то, что при образовании 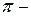 связи возникает две области перекрытия, тем не менее
связи возникает две области перекрытия, тем не менее 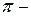 связи более слабые, чем
связи более слабые, чем 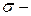 связи, так как в случае
связи, так как в случае 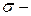 связи степень перекрытия электронных облаков атомов выше. При этом двойная связь состоит из одной
связи степень перекрытия электронных облаков атомов выше. При этом двойная связь состоит из одной 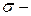 связи и одной
связи и одной 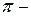 связи, тройная связь – из одной
связи, тройная связь – из одной 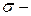 связи и двух
связи и двух 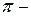 связей.
связей.
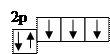 Образование кратной (тройной) связи рассмотрим на примере образования молекулы
Образование кратной (тройной) связи рассмотрим на примере образования молекулы 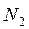 .
.
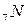
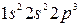
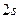
Из графического изображения валентных электронов видно, что из 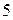 электронов, находящихся на внешнем уровне, три
электронов, находящихся на внешнем уровне, три 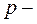 электрона являются не спаренными и образуют три общие электронные пары. В результате этого каждый атом азота в молекуле
электрона являются не спаренными и образуют три общие электронные пары. В результате этого каждый атом азота в молекуле 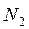 приобретает устойчивую электронную
приобретает устойчивую электронную
 |
структуру


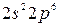 (электронный октет). Тогда схему перекрывания облаков в молекуле
(электронный октет). Тогда схему перекрывания облаков в молекуле 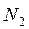 можно изобразить следующим образом:
можно изобразить следующим образом:
Рисунок 4.6 – Схематическое изображение  и
и  связей в молекуле азота
связей в молекуле азота
Таким образом, в молекуле азота реализуются две 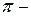 связи вдоль осей
связи вдоль осей 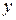 и
и 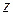 и одна
и одна 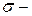 связь – вдоль оси
связь – вдоль оси 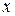 .
.
Дата добавления: 2015-07-18; просмотров: 696;
