Моноклональні антитіла. Функціональна структура антитіл
Злиття клітин лежить в основі одержання гібридних клітин, продукуючих антитіла. Антитіла – білки сироватки крові, які синтезуються в організмі як прояв захисної реакції при введенні в нього чужорідної речовини (антигену). Імунна система виробляє специфічні антитіла на величезну кількість антигенів. В основі такої здатності лежить наявність великого різноманіття клонів лімфоцитів, кожний з яких виробляє антитіла з вузькою специфічністю. Всі вони називаються імуноглобулінами (Ig), антитіла становлять один з головних білкових компонентів крові – близько 20% сумарного білка плазми.
Як антигени виступають різні речовини: клітини мікроорганізмів, віруси, білки, нуклеїнові кислоти, у деяких випадках низькомолекулярні речовини типу антибіотиків або пестицидів. Антитіла утворюються не проти всієї молекули білка або бактеріальної клітини, а тільки до невеликих ділянок на їхній поверхні, що отримали назву антигенних детермінант. У випадку білкової молекули антигенною детермінантою є ділянки поверхні, які містять близько 5 амінокислотних залишків.
Найпростіші молекули антитіл мають форму букви Y із двома ідентичними антиген-зв’язуючими ділянками – по одному на кінці кожної із двох “гілок”. Зв’язування антигенних детермінант призводить до втрати певних функцій молекули або клітини, на чому й заснований захисний механізм дії антитіл. Оскільки ділянки дві, вони можуть зшивати антигени:
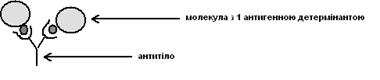
Якщо молекула антигену має три або більше антигенних детермінант, то антитіла можуть зшивати їх у велику сітку. Досягнувши певних розмірів, така сітка може випасти з розчину в осад:

Тенденція великих імунних комплексів до осадження (преципітації) зручна для виявлення антитіл й антигенів. Утворення таких комплексів може призводити до аглютинації (склеювання) молекул. Це явище лежить в основі визначення груп крові, коли еритроцити склеюються антитілами тієї або іншої специфічності – реакція гемаглютинації.
Молекула антитіла утворена чотирма поліпептидними ланцюгами (рис. 7).
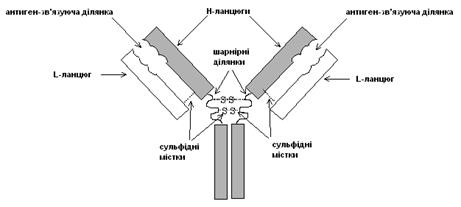
Рис. 7. Будова антитіла
Два з них – ідентичні легкі (L-ланцюг, з 220 амінокислот), а два – важкі (H-ланцюги, з 440 амінокислот). Всі чотири ланцюги з’єднані між собою нековалентними й ковалентними (дисульфідними) зв’язками. Антиген-зв’язуючі ділянки утворюються за рахунок одного H й одного L-ланцюга. Ефективність реакцій зв’язування антигену зростає завдяки гнучкій шарнірній ділянці антитіла, що дозволяє змінювати відстань між двома антиген-зв’язуючими ділянками. Шарнірна ділянка перебуває на H-ланцюзі. H-ланцюг утворює також “хвостову” ділянку молекули, що містить також одну або декілька олігосахаридних ланцюгів, функція яких нез’ясована. Як L, так і Н-ланцюг побудовані з повторюваних сегментів, або доменів, кожний з яких згортається незалежно, утворюючи компактну функціональну одиницю (епітоп). Ці ділянки також можуть виступати в якості антигенних детермінант й, відповідно, зв’язуватися іншими антитілами.
Дата добавления: 2015-07-14; просмотров: 1584;
