Розподіл електронів за станами. Періодична система елементів
Сукупність електронів, які перебувають у всіх можливих станах з однаковим значенням головного квантового числа n, утворює електронну оболонку (електронний шар). Енергетичні шари прийнято позначати великими латинськими літерами відповідно до значень головного квантового числа.
Найближче до ядра в будь-якому атомі розташований К-шар, для якого n=1. Далі йдуть L-шар (n=2), M-шар (n=3), N-шар (n=4), тощо. Кількість електронів у шарі визначається формулою
 (1.5.5)
(1.5.5)
де n ― головне квантове число.
Згідно з формулою (1.5.5), в К-шарі міститься не більше двох електронів (два s-електрони); в L-шарі не більше восьми електронів (із них два в s-стані і шість в р-стані); в М-шарі не більше вісімнадцяти електронів (із яких два в s-стані, шість в р-стані і десять в d-стані) і т. д. Число електронів в тому чи іншому квантовому стані визначається за формулою
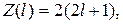 (1.5.6)
(1.5.6)
де l ― орбітальне квантове число.
Згідно з формулою (1.5.5), в s-стані перебуває не більше двох електронів (l=0); в p-стані перебуває не більше шeсти електронів (l=1); в d- стані перебуває не більше десять електронів (l=2); в f-стані не більше чотирнадцяти електронів (l=3), тощо.
Для станів із фіксованими квантовими числами n і l використовують позначення типу 1s,2s,2p і т.д.: значення n вказується цифрою, яка стоїть зліва від букви, що вказує значення числа l. Як уже було відмічено в кожній такій групі є 2(2l+1) станів. Вони відрізняються різними значеннями магнетного квантового числа ml, значення спінового квантового числа можуть бути лише ms=1/2 і ms=-1/2.
Наприклад, у кожного стану із групи 1s орбітальне квантове число l=0, так що група 1s містить лише два окремі квантові стани. В цих станах
n=1, l=0, ml=0, ms=1/2,
n=1, l=0, ml=0, ms=-1/2.
Група 2s також містить два стани, оскільки в ній також l=0; група 2p містить уже 2(2l+1)=6 станів. В цих станах:
n=2, l=1, ml=1, ms=1/2,
n=2, l=1, ml=1, ms=-1/2,
n=2, l=1, ml=0, ms=1/2,
n=2, l=1, ml=0, ms=-1/2,
n=2, l=1, ml=-1, ms=-1/2,
n=2, l=1, ml=-1, ms=-1/2.
Аналогічно можна показати, що в d-стані число електронів не може перевищувати 10; в f-стані ― не більше 14.
Розподіл електронів за одночастинковими станами називається електронною конфігурацією. Електронні конфігурації позначаються символами типу 1s2 2s2 2p6 3s2. Тут цифрою над s i p справа, вказують число електронів в станах 1s, 2s, 2p i 3s.
Якщо шар повністю заповнений, то він називається замкнутим.
Кожен період таблиці Менделєєва починається елементом, який перебуває в стані 1s1, 2s1, 3s1, і т.д. Закінчується період елементом із повністю заповненим зовнішнім електронним шаром.
Процес забудови електронних оболонок в елементів перших двох періодів таблиці Менделєєва показано нижче:
1H 1s1
2He 1s2
3Li 1s22s1
4Be 1s22s2
5B 1s22s22p1
6C 1s22s22p2
7N 1s22s22p3
8O 1s22s22p4
9F 1s22s22p5
10Ne 1s22s22p6
18Ar 1s22s22p63s23p6
36Kr 1s22s22p63s23p63d104s24p6
Електронні оболонки інертних газів є повністю заповненими.
Періодичність властивостей атомів пояснюється періодичністю заповнення їх електронних оболонок, яка випливає з принципу Паулі. Періодичність фізичних властивостей окремих хімічних елементів виявляється насамперед у структурі лінійчатих спектрів, які випромінюють атоми цих елементів. Подібність спектрів лужних металів обумовлена подібністю забудови зовнішніх електронних оболонок. Це пояснюється тим, що оптичні лінійчаті спектри випромінюються електронами зовнішніх електронних оболонок. Періодичність властивостей хімічних елементів проявляється також і в електричних властивостях атомів.
В основі періодичного закону лежить не лише уявлення про періодичну залежність властивостей елементів, а й уявлення про закономірний зв’язок між властивостями елементів у кожному періоді і в кожній групі періодичної системи, а також усередині цієї системи по діагональних напрямках. Саме цей закономірний зв’язок між кількісними і якісними характеристиками елементів, вперше відкритий і досліджений Менделєєвим, дав змогу йому передбачити існування й властивості невідомих на той час хімічних елементів.
Періодичний закон став одним з основних законів природознавства, які становлять фундамент сучасного фізичного вчення про будову матерії.
Дата добавления: 2015-08-26; просмотров: 973;
