Взаємодія атомів. Іонний і ковалентний зв’язок атомів у молекулах. Поняття про теорію обмінних сил
Молекули складаються з однакових або різних атомів, сполучених між собою в одне ціле міжатомними зв’язками. Існування молекул як стійких систем показує, що хімічні зв’язки атомів у молекулах повинні бути зумовлені наявністю між атомами деяких сил взаємодії, які зв’язують атоми в молекулах. Для роз’єднання молекули на атоми слід виконати певну роботу. Це підтверджує факт виділення енергії при утворенні молекули. Так, наприклад, два атоми водню у вільному стані мають більшу енергію ніж ті самі атоми, сполучені у двохатомну молекулу. Це є доказом наявності сил, які зв’язують атоми в молекулах, причому енергія, яка виділяється при утворенні молекули, є мірою тих сил взаємодії.
Експерименти показують, що сили міжатомної взаємодії в молекулах виникають між зовнішніми, валентними електронами атомів. Про це свідчить різка зміна оптичного спектра атомів при утворенні ними молекул і, навпаки, збереження особливостей рентгенівського характеристичного спектра атомів незалежно від того вільні атоми чи утворюють молекулярні сполуки.
Важливо відмітити, що атоми на значних відстанях не взаємодіють один з одним. Із зменшенням відстані r між ядрами атомів зростають сили взаємного притягання. Проте ці сили не єдині. На малих відстанях між атомами виникають сили взаємного відштовхування, величина яких різко зростає в момент перекриття електронних оболонок. Сили відштовхування більш короткої дії, ніж сили притягання. На рис.1.19 наведено криві залежності від відстані r сил притягання F2; відштовхування F1 і результуючої сили F взаємодії атомів у такій молекулі, причому сили відштовхування вважаються додатними.
Bнаслідок протилежної дії сил F1 i F2 на деякій відстані r0 між атомами обидві сили врівноважуються і її геометрична сума стає рівною нулю.

Рис.1.19
На цій відстані найменша взаємна потенціальна енергія W(r) атомів двохатомної молекули. На рис.1.20 зображено криву залежності від r потенціальної енергії W(r) взаємодії двох атомів у молекулі.

Рис. 1.20
Величина D (рис.1.0) чисельно дорівнює роботі, яку потрібно виконати, щоб розірвати зв’язки атомів у молекулі, тобто роз’єднати молекулу на атоми. Цю роботу ще називають енергією дисоціації молекули або енергією зв’язку. Зрозуміло, що при утворенні молекули з окремих атомів, така енергія повинна звільнитись.
Нехай один з атомів у результаті взаємодії приєднує до себе один або кілька електронів і стає негативним іоном, а інший атом віддає відповідну кількість електронів і перетворюється в позитивний іон. Такі атоми за рахунок електростатичного притягання утворюють молекулу. Молекули в яких здійснюється такий тип зв’язку називають іонними або гетерополярними молекулами.
Однак більшість молекул у природі утворенні з електрично нейтральних атомів. Хімічний зв’язок, який здійснюється між електрично нейтральними атомами в молекулі називають ковалентним, або гемополярним. Природу ковалентного зв’язку вдалось з’ясувати лише на основі квантової механіки.
Зупинимось більш детально на механізмі утворення іонних молекул. Типовим прикладом такої молекули є кухонна сіль NaCl. Метали першої групи таблиці Менделєєва мають порівняно невеликі значення потенціалу іонізації. Так для натрію потенціал іонізації становить 5,1 еВ. З другого боку електронна спорідненість атома хлору має значну величину, порядку 3,8 еВ. Перехід електрона від атома Na до атома Cl приводить до утворення іонів Na+ i Cl-, які притягуючись між собою за допомогою електростатичних сил, утворюють стійку молекулу з іонним зв’язком. Електростатичне притягання між іонами Na+ i Cl- на певній відстані врівноважується електростатичним відштовхуванням оболонок обох іонів. Іонний зв’язок не може бути насиченим.
Порівняння потенціалу іонізації атомів натрію і електронної спорідненості атомів хлору показує, що майже завжди величина еj енергії іонізації трохи перевищує електронну спорідненість. Для кухонної солі це перевищення становить 1,3 еВ. Отже електрон від атома натрію не може самочинно перейти до атома хлору. В той же час, при утворенні молекули NaCl енергія виділяється. Пояснити цей процес можна лише значним зближенням іонів, від чого виділяється електростатична енергія їх взаємодії. Утворення іонів і їх зближення ― це єдиний процес, який відбувається одночасно і лише після того як атоми так наблизилися, що разом з утворенням іонів виділяється потрібна для цього кількість енергії.
Ковалентний хімічний зв’язок здійснюється між нейтральними атомами. Цей зв’язок має властивість насичення. Атом водню може вступити у взаємодію лише з одним атомом водню. Атом вуглецю при взаємодії може зв’язати лише чотири атома водню і т.д.
Таким чином, насичення ковалентних зв’язків є істотним не класичним ефектом. Можливість його пояснення за допомогою гравітаційних сил в цьому випадку повністю виключається.
Кількісну теорію ковалентного зв’язку, стосовно молекули водню, розробили Гейтлер і Лондон ще у 1927 р. на основі квантової механіки. Розглянемо два атоми водню, ядра яких перебувають у точках 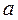 і
і 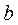 на відстані R. Якщо відстань R дуже велика, то атоми не взаємодіють і повна енергія системи із двох атомів водню дорівнюватиме подвійній енергії основного стану атома водню, тобто:
на відстані R. Якщо відстань R дуже велика, то атоми не взаємодіють і повна енергія системи із двох атомів водню дорівнюватиме подвійній енергії основного стану атома водню, тобто:
W=2W1,
де
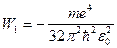 .
.
При наближенні атомів між ними виникає взаємодія, яка характеризується деякою енергією Wp( R ), що залежить від відстані між атомами. Загальна енергія тоді буде рівною
W=2W1+WP ( R ). (1.6.1)
Якщо R®¥, то Wp(R)®0. При наближенні двох атомів водню один до одного Wp(R) спочатку буде зменшуватись від 0 (при R=¥) до деяких від’ємних значень (при скінченних R), що відповідає притяганню атомів. Потім при зменшенні R Wp(R) буде зростати, що відповідає відштовхуванню атомів. Такий характер зміни Wp(R) не залежить від природи хімічного зв’язку і показаний на рис. 1.21.
На рис. 1.21 зображені електронні хмари двох атомів водню, які при скінченій відстані R між ядрами частково перекриваються.
Обидва електрони в молекулі водню є тотожні й нерозрізнені частинки. Згідно з принципом Паулі при переміні місцями цих електронів система не зміниться.
Однак стан такої системи у квантовій механіці може визначатись або симетричною або антисиметричною хвильовою функцією. У цьому випадку хвильова функція повинна бути обов’язково антисиметричною.

Рис. 1.21
Енергія взаємодії Wp(R) буде визначатись з урахуванням обох можливих станів молекули водню за формулою:
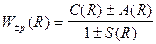 , (1.6.2)
, (1.6.2)
де знак плюс стосується випадку опису стану молекули симетричною координатною хвильовою функцією, а мінус ― антисиметричною координатною функцією.
Безрозмірний інтеграл S(R) називають інтегралом перекривання; він характеризує перекривання електронних хмар при наближенні атомів один до одного. При R®¥, коли атоми не взаємодіють, інтеграл S(R) перетворюється в нуль. Найбільшого значення S(R)=1 цей інтеграл досягає при R=0, коли обидва атоми сумістяться своїми ядрами і оболонками. Зрозуміло, що таких випадків не буває. В молекулі водню Н2 інтеграл S(R) має додатне значення менше за одиницю. На знак енергії Wp(R) інтеграл S(R) не впливає.
Інтеграл C(R) називають кулонівським інтегралом. Він характеризує кулонівську взаємодію ядер і електронів у молекулі Н2. Найбільший інтерес становить інтеграл А(R) , який називають обмінним інтегралом. Наявність цього інтеграла пов’язана з нерозрізненістю електронів у молекулі й можливістю їх перестановки місцями. Інтеграл А(R) має розмірність енергії і характеризує особливу квантово-механічну взаємодію, яка виникає між двома тотожними електронами, і яку умовно називають «обмінною взаємодією». «Обмінну взаємодію» електронів у молекулі водню розуміють так, що електрон кожного з її атомів періодично перебуває то біля одного атома, то біля іншого атома, здійснюючи тим самим зв’язок обох атомів. Сили, які проявляються при цьому, називають «обмінними».
Розрахунки показують, що на великих відстанях C(R) i A(R) мають безмежно малі значення. На великих відстанях взаємодія між окремими атомами водню відсутня. На середніх відстанях, сумірна із борівським радіусом водневого атома, обидва інтеграли C(R) i A(R) є від’ємні, причому çA(R)ç>çC(R)ç. Тому енергія у формулі (1.6.2) матиме такі два значення:
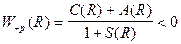 ;
; 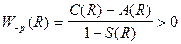 . (1.6.3)
. (1.6.3)
Перше з них W+p(R) відповідає притяганню і характеризує стійкий стан молекули водню. Друге W-p(R) відповідає відштовхуванню і визначає нестійкий стан молекули. Для стійкого стану молекули, координатна хвильова функція є симетричною, а спіни електронів повинні бути антипаралельними. Лише в такому випадку за принципом Паулі повна хвильова функція буде антисиметричною*. У нестійкому стані молекули водню координатні хвильові функції є антисиметричними. Для збереження антисиметричного характеру повної хвильової функції необхідно, щоб спіни електронів в обох атомах молекули були паралельними.
*Y( r ) ― координатна хвильова функція,
Y( r,q,j ) ― повна хвильова функція.
Дата добавления: 2015-08-26; просмотров: 1676;
