Физико-химические методы количественного анализа позволяют определять состав вещества, не прибегая к использованию химикатов, т.е. когда химические реакции не протекают.
Методы анализа, основанные на наблюдении физических явлений, происходящих при протекании определенных химических реакций, называют физико-химическими методами. Наибольшее распространение среди физико-химических методов нашли методы колориметрии, потенциометрического титрования, кулонометрии и хроматорграфии.
Сущность метода потенциометрического титрования заключается в том, что эквивалентную точку определяют не по изменению цвета индикатора, а по изменению потенциала электрода. Электрод, которым пользуются при потенциометрическом титровании для определения точки эквивалентности, носит названия индикаторного. Индикаторный электрод должен быть обратим по отношению к титруемому веществу или к ионам прибавляемого реагента. В зависимости от того, является ли электрод обратим по отношению к ионам реагента или титруемого вещества, потенциал его по мере титрования будет изменяться (рис. 1) согласно уравнению
E = E0м + 0,059 / z lg[M+z],
или для водородного электрода E = E0н + 0,03 lg[Н+],
где Е0 – стандартный потенциал электрода при концентрации иона металла или иона водорода, равном 1. В данном уравнении принято, что коэффициент активности металла равен 1.
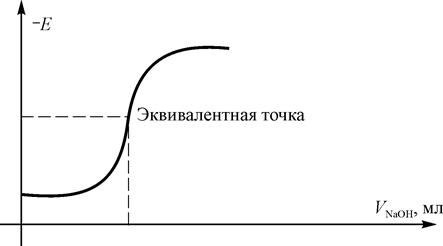
Рис. 1 Вид кривой титрования хлороводородной кислоты едким натром
Потенциометрический метод титрования используется для количественного определения содержания в растворе кислот (метод нейтрализации), галогенов (метод осаждения) и ряда других ионов (метод комплексообразования).
Колориметрия, или колориметрический анализ, основана на определении концентрации вещества по интенсивности окраски раствора или на переводе определяемой части анализируемого объекта в окрашенное соединение. Для окраски исследуемого вещества используются как органические, так и неорганические реагенты.
Из оптических методов анализа наиболее широкое распространение нашли колориметрические методы, основанные на измерении интенсивности светового потока, прошедшего через окрашенный раствор. В колориметрии используется, как правило, длина воды от 400 до 750 нм.
Зависимость между интенсивностью прошедшего света через раствор (J) и концентрацией окрашенного вещества (с), толщиной светопоглощающего раствора (l) и интенсивностью падающего на раствор света (Jo) носит название закона Бугера–Ламберта–Бера и выражается уравнением: D = lgJo / J = e c l, (где e – коэффициент поглощения света, постоянная величина, характерная для каждого окрашенного вещества и зависящая от его природы).
Величина lgJo / J является важной характеристикой окрашенного раствора, ее называют оптической плотностью раствора (D). Из всего этого следует, что оптическая плотность раствора прямо пропорциональна концентрации окрашенного вещества и толщине слоя раствора. Данное соотношение справедливо для разбавленных концентраций растворов (меньше 0,01 М). При более высоких концентрациях закон Бугера–Ламберта–Бера не соблюдается вследствие взаимного влияния частиц на их способность поглощать свет. Закон Бугера–Ламберта–Бера справедлив для монохроматического излучения, тогда как при использовании светофильтра с достаточно широкой областью пропускания наблюдается отклонение от прямолинейности.
Определение концентрации окрашенного вещества методом фотоколориметрии производят методом сравнения оптических плотностей стандартного и исследуемого растворов, методом построения градуировочного графика и методом добавок.
Дата добавления: 2015-08-26; просмотров: 1150;
