Лекция 15. Общие химические свойства металлов
С химической точки зрения металл – это элемент, который во всех соединениях проявляет положительную степень окисления.Из известных в настоящее время 109 элементов 86 являются металлами. Основной отличительной особенностью металлов является наличие в конденсированном состоянии свободных, не связных с определенным атомом электронов. Эти электроны способны перемещаться по всему объему тела. Наличие свободных электронов определяет всю совокупность свойств металлов. В твердом состоянии большинство металлов имеет кристаллическую высокосимметричную структуру одного из типов: кубическую объемноцентрированную, кубическую гранецентрированную или гексагональную плотноупакованную (рис. 2).
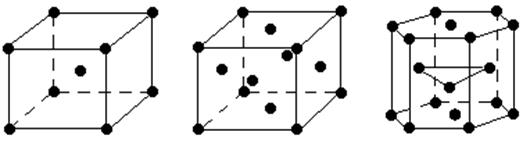
а) б) в)
Рис. 2 Типичная структура кристалла металлов:
а – кубическая объемноцентрированная;
б – кубическая гранецентрированная;
в – плотная гексагональная
Существует техническая классификация металлов. Обычно выделяют следующие группы: черные металлы (Fe); тяжелые цветные металлы
(Cu, Pb, Zn, Ni, Sn, Co, Sb, Bi, Hg, Cd), легкие металлы с плотностью менее
5 г/см3 (Al, Mg, Ca и т.д.), драгоценные металлы (Au, Ag и платиновые металлы) и редкие металлы (Be, Sc, In, Ge и некоторые другие).
В химии металлы классифицируются по их месту в периодической системе элементов. Различают металлы главных и побочных подгрупп. Металлы главных подгрупп называют непереходными. Эти металлы характеризуются тем, что в их атомах происходит последовательное заполнение s- и p-электрон-ных оболочек.
Типичными металлами являются s-элементы (щелочные Li, Na, K, Rb, Cs, Fr и щелочноземельные Be, Mg, Ca, Sr, Ba, Ra металлы). Данные металлы расположены в Iа и IIа подгруппах (т. е., в главных подгруппах I и II групп). Этим металлам отвечает конфигурация валентных электронных оболочек ns1 или ns2 (n – главное квантовое число). Для данных металлов характерно:
а) металлы имеют на внешнем уровне 1–2 электрона, поэтому проявляют постоянные степени окисления +1, +2;
б) оксиды этих элементов носят основной характер (исключение –бериллий, т.к. малый радиус иона придает ему амфотерные свойства);
в) гидриды имеют солеобразный характер и образуют ионные кристаллы;
г) возбуждение электронных подуровней возможно только у металлов IIА группы с последующей sp-гибридизацией орбиталей.
К p-металлам относятся элементы IIIа (Al, Ga, In, Tl), IVа (Ge, Sn, Pb), Vа (Sb, Bi) и VIа (Ро) групп с главными квантовыми числами 3, 4, 5, 6. Данным металлам отвечает конфигурация валентных электронных оболочек ns2pz (z может принимать значение от 1 до 4 и равно номеру группы минус 2). Для данных металлов характерно:
а) образование химических связей осуществляется s- и p-электронами в процессе их возбуждения и гибридизации (sp- и spd-), однако сверху вниз по группам способность к гибридизации падает;
б) оксиды p-металлов амфотерные или кислотные (основные оксиды только у In и Tl);
в) гидриды p-металлов имеют полимерный характер (AlH3)n или газообразный (SnH4 ,PbH4 и т.д.), что подтверждает сходство с неметаллами, открывающими эти группы.
В атомах металлов побочных подгрупп, называемых переходными металлами, происходит застраивание d- и f-оболочек, в соответствии с чем их делят на d-группу и две f-группы лантаноиды и актиноиды.
К переходным металлам относят 37 элементов d-группы и 28 металлов f-группы. К металлам d-группы относят элементы Ib (Cu, Ag, Au), IIb (Zn, Cd, Hg), IIIb (Sc, Y, La, Ac), IVb (Ti, Zr, Hf, Db), Vb (V, Nb, Ta, Jl), VIb (Cr, Mo, W, Rf), VIIb (Mn, Tc, Re, Bh) и VIII групп (Fe, Co, Ni, Ru, Rh, Pd, Os, Ir, Rt, Hn, Mt, Db, Jl, Rf, Bh, Hn, Mt). Этим элементам отвечает конфигурация 3dz4s2. Исключения составляют некоторые атомы, в том числе атомы хрома с полузаполненной 3d5-оболочкой (3d54s1) и меди – с полностью заполненной 3d10-оболочкой (3d104s1). Эти элементы обладают некоторыми общими свойствами:
1) все они образуют сплавы между собой и другими металлами;
2) наличие частично заполненных электронных оболочек обусловливает способность d-металлов образовывать парамагнитные соединения;
3) в химических реакциях они проявляют переменную валентность (за немногими исключениями), а их ионы и соединения, как правило, окрашены;
4) в химических соединениях d-элементы электроположительны. «Благородные» металлы, обладая высоким положительным значением стандартного электродного потенциала (Е > 0), взаимодействуют с кислотами необычным образом;
5) ионы d-металлов имеют вакантные атомные орбитали валентного уровня (ns, np, (n – 1) d), поэтому они проявляют акцепторные свойства, выступая в качестве центрального иона в координационных (комплексных) соединениях.
Химические свойства элементов определяются их положением в Периодической системе элементов Менделеева. Так, металлические свойства сверху вниз в группе возрастают, что обусловлено уменьшением силы взаимодействия между валентными электронами и ядром вследствие увеличения радиуса атома и за счет возрастания экранирования электронами, расположенными на внутренних атомных орбиталях. Это приводит к облегчению ионизации атома. В периоде металлические свойства уменьшаются слева направо, т.к. это связано с увеличением заряда ядра и тем самым с увеличением прочности связи валентных электронов с ядром.
В химическом отношении атомы всех металлов характеризуются сравнительной легкостью отдачи валентных электронов (т.е. малой величиной энергии ионизации) и низким значением сродства к электрону (т.е. малой способностью удерживать избыточные электроны). Как следствие этого – низкое значение электроотрицательности, т.е. способность образовывать только положительно заряженные ионы и проявлять в своих соединениях только положительную степень окисления. В связи с этим металлы в свободном состоянии являются восстановителями.
Восстановительная способность разных металлов неодинакова. Для реакций в водных растворах она определяется значением стандартного электродного потенциала металла (т.е. положением металла в ряду напряжений) и концентрацией (активностью) его ионов в растворе.
Взаимодействие металлов с элементарными окислителями (F2, Cl2, O2, N2, S и т.д.). Например, реакция с кислородом, как правило, протекает следующим образом:
2Me + 0,5nO2 = Me2On,
где n – валентность металла.
Взаимодействие металлов с водой. Металлы, обладающие стандартным потенциалом менее –2,71 В, вытесняют водород из воды на холоде с образованием гидроксидов металлов и водорода. Металлы со стандартным потенциалом от –2,7 до –1,23 В вытесняют водород из воды при нагревании:
Me + nH2О = Me(OH)n + 0,5n H2.
Остальные металлы с водой не реагируют.
Взаимодействие с щелочами. С щелочами могут реагировать металлы, дающие амфотерные оксиды, и металлы, обладающие высокими степенями окисления, в присутствии сильного окислителя. В первом случае металлы образуют анионы своих кислот. Так, реакция взаимодействия алюминия с щелочью запишется уравнением
2Al + 6H2O + 2NaOH = 2Na[Al(OH)4] + 3H2,
в котором лигандом является ион гидроксида. Во втором случае образуются соли, например K2CrO4 .
Взаимодействие металлов с кислотами. С кислотами металлы реагируют различно в зависимости от численного значения стандартного электродного потенциала (Е) (т.е. от положения металла в ряду напряжения) и окислительных свойств кислоты:
1. В растворах галогеноводородов и разбавленной серной кислоты окислителем является только ион Н+, и поэтому с этими кислотами взаимодействуют металлы, стандартный потенциал которых меньше стандартного потенциала водорода:
Me + 2n H+ = Men+ + n H2.
2. Концентрированная серная кислота растворяет почти все металлы, не зависимо от положения их в ряду стандартных электродных потенциалов (кроме Au и Pt). Водород при этом не выделяется, т.к. функцию окислителя в кислоте выполняет cульфат-ион (SO42–). В зависимости от концентрации и условий проведения опыта cульфат-ион восстанавливается до различных продуктов. Так, цинк, в зависимости от концентрации серной кислоты и температуры, реагирует следующим образом:
Zn + H2SO4(разб.) = ZnSO4 + H2;
Zn + 2H2SO4(конц.) = ZnSO4 + SO2 +H2O;
– при нагревании:
3Zn + 4H2SO4(конц.) = 3ZnSO4 + S + 4H2O;
– при очень высокой температуре:
4Zn + 5H2SO4(конц.) = 4ZnSO4 + H2S +4H2O.
3. В разбавленной и концентрированной азотной кислоте функцию окислителя выполняет нитрат-ион (NO3–), поэтому продукты восстановления зависят от степени разбавления азотной кислоты и активности металлов. В зависимости от концентрации кислоты, металла (величины его стандартного электродного потенциала) и условий проведения опыта нитрат-ион восстанавливается до различных продуктов. Так, кальций, в зависимости от концентрации азотной кислоты, реагирует следующим образом:
4Ca +10HNO3(оч. разб) = 4Ca(NO3)2 + NH4NO3 + 3H2O;
4Ca + 10HNO3(конц) = 4Ca(NO3)2 + N2O + 5H2O.
Концентрированная азотная кислота не реагирует (пассивирует) с железом, алюминием, хромом, платиной и некоторыми другими металлами.
Взаимодействие металлов друг с другом. При высоких температурах металлы способны реагировать друг с другом с образованием сплавов. Сплавы могут быть твердыми растворами и химическими (интерметаллическими) соединениями (Mg2Pb, SnSb, Na3Sb8, Na2K и др.).
Свойства металлического хрома(…3d54s1).Простое вещество хром представляет собой блестящий на изломе серебристый металл, который хорошо проводит электрический ток, имеет высокую температуру плавления (1890°С) и кипения (2430°С), большую твердость (в присутствии примесей, очень чистый хром мягок) и плотность (7,2 г/см3).
При обычной температуре хром устойчив к действию элементарных окислителей и воде благодаря плотной окисной пленке. При высоких температурах хром взаимодействует с кислородом и другими окислителями.
4Cr + 3O2 ® 2Cr2O3;
2Cr + 3S(пар) ® Cr2S3;
2Cr + 3Cl2(газ) ® 2CrCl3 (малиновый цвет)
Cr + HCl(газ) ® CrCl2 + Н2 ↑;
2Cr + N2 ® 2CrN (или Cr2N).
С металлами при сплавлении хром образует интерметаллиды (FeCr2, CrMn3). При 600°С хром взаимодействует с парами воды:
2Cr + 3H2O ® Cr2O3 + 3H2.
В электрохимическом отношении металлический хром близок к железу: 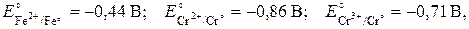 . Поэтому он может растворяться в неокисляющих (по аниону) минеральных кислотах, таких как галогеноводородные:
. Поэтому он может растворяться в неокисляющих (по аниону) минеральных кислотах, таких как галогеноводородные:
Сr + 2HCl ® CrCl2(голубой цвет) + H2.
На воздухе идет быстро следующая стадия:
2CrCl2 + 1/2O2 + 2HCl ® 2CrCl3(зеленый цвет) + H2O.
Окисляющие (по аниону) минеральные кислоты растворяют хром до трехвалентного состояния:
2Cr + 6H2SO4 ® Cr2(SO4)3 + 3SO2 + 6H2O.
В случае с HNO3(конц) происходит пассивация хрома – на поверхности образуется прочная пленка оксида – и металл не реагирует с кислотой (пассивный хром имеет высокий окислительно-восстановительный потенциал, равной + 1,3 В).
Основная область применения хрома – металлургия: создание хромистых сталей. Так, в инструментальную сталь вводят 3–4% хрома, шарикоподшипниковая сталь содержит 0,5–1,5% хрома; в нержавеющей стали (один из вариантов) 18–25% хрома, 6–10% никеля, <0,14% углерода, ~0,8% титана, остальное – железо.
Свойства металлического железа (…3d64s2). Железо – белый блестящий металл, образует несколько кристаллических модификаций, устойчивых в определенном температурном интервале.
Химические свойства металлического железа определяются его положением в ряду напряжений металлов: 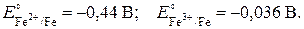
При нагревании в атмосфере сухого воздуха железо окисляется:
2Fe + 3/2O2 ® Fe2O3.
В зависимости от условий и от активности неметаллов железо может образовывать металлоподобные (Fe3C, Fe3Si, Fe4N), солеподобные (FeCl2, FeS) соединения и твердые растворы (с C, Si, N, B, P, H).
В воде железо интенсивно корродирует:
2Fe + 3/2O2 + nH2O ® Fe2O3×nH2O.
При недостатке кислорода образуется смешанный оксид Fe3O4:
3Fe + 2O2 + nH2O ® Fe3O4×nH2O.
Разбавленная соляная, серная и азотная кислоты растворяют железо до двухвалентного иона:
Fe + 2HCl ® FeCl2 + H2;
4Fe + 10HNO3(оч. разб.) ® 4Fe(NO3)2 + NH4NO3 + 3H2O.
Более концентрированная азотная и горячая концентрированная серная кислоты окисляют железо до трехвалентного состояния (выделяются NO и SO2, соответственно):
Fe + 4HNO3 ® Fe(NO3)3 + NO + 2H2O.
Очень концентрированная азотная кислота (плотность 1,4 г/см3) и серная (олеум) пассивируют железо, образуя на поверхности металла оксидные пленки.
Железо используют для получения железоуглеродистых сплавов. Велико биологическое значение железа, т.к. оно – составная часть гемоглобина крови. В организме человека содержится около 3 г железа.
Химические свойства металлического цинка(…3d104s2). Цинк – синевато-белый, пластичный и тягучий металл, но выше 200°С становится хрупким. Во влажном воздухе он покрывается защитной пленкой основной соли ZnCO3×3Zn(OH)2 или ZnO и дальнейшего окисления не происходит. При высоких температурах взаимодействует:
2Zn + O2 ® 2ZnO;
Zn + Cl2 ® ZnCl2;
Zn + 2H2O(пар) ® Zn(OH)2 + H2.
Исходя из величин стандартных электродных потенциалов, цинк вытесняет кадмий, который является его электронным аналогом, из солей:
Cd2+ + Zn ® Cd + Zn2+.
Благодаря амфотерности гидроокиси цинка металлический цинк способен растворяться в щелочах:
Zn + 2KOH + 2H2O ® K2 [Zn(OH)4] + H2 ↑;
в разбавленных кислотах:
Zn + H2SO4 ® ZnSO4 + H2 ↑;
4Zn + 10HNO3 ® 4Zn(NO3)2 + NH4NO3 + 3H2O;
в концентрированных кислотах:
4Zn + 5H2SO4 ® 4ZnSO4 + H2S + 4H2O;
3Zn + 8HNO3 ® 3Zn(NO3)2 + 2NO + 4H2O.
Значительная часть цинка расходуется для цинкования железных и стальных изделий. Широкое промышленное использование имеют сплавы цинка с медью (нейзильбер, латунь). Цинк широко используется при изготовлении гальванических элементов.
Химические свойства металлической меди (…3d104s1). Металлическая медь кристаллизуется в кубической гранецентрированной кристаллической решетке. Это ковкий, мягкий, вязкий металл розового цвета с температурой плавления 1083°С. Медь находится на втором месте после серебра по электро- и теплопроводности, что обусловливает значение меди для развития науки и техники.
Медь реагирует с поверхности с кислородом воздуха при комнатной температуре, цвет поверхности становится темнее, а в присутствии CO2, SO2 и паров воды покрывается зеленоватой пленкой основных солей (CuOH)2CO3, (CuOH)2SO4.
Медь непосредственно соединяется с кислородом, галогенами, серой:
2Cu + O2  2CuO;
2CuO;
4CuO  2Cu2O + O2;
2Cu2O + O2;
Cu + S ® Cu2S.
В присутствии кислорода металлическая медь взаимодействует с раствором аммиака при обычной температуре:
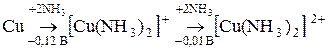 .
.
Находясь в ряду напряжений после водорода  ,
,
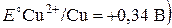 медь не вытесняет его из разбавленных соляной и серной кислот. Однако в присутствии кислорода воздуха медь растворяется в этих кислотах:
медь не вытесняет его из разбавленных соляной и серной кислот. Однако в присутствии кислорода воздуха медь растворяется в этих кислотах:
2Cu + 4HCl + O2 ® 2CuCl2 + 2H2O.
Окисляющие кислоты растворяют медь с переходом ее в двухвалентное состояние:
Cu + 2H2SO4 ® CuSO4 + SO2 + 2H2O;
3Cu + 8HNO3(конц.) ® 3Cu(NO3)2 + NO2 + 4H2O.
Со щелочами медь не взаимодействует.
Соли меди реагируют с более активными металлами, и эта окислительно-восстановительная реакция лежит в основе некоторых гальванических элементов:
CuSO4 + Zn® ZnSO4 +Cu; Eо = 1,1 B;
Mg + 2CuCl2 ® MgCl2 + 2Cu; Eо = 1,75 B.
Медь образует с другими металлами большое число интерметаллических соединений. Наибольшую известность и ценность имеют сплавы: латунь Cu–Zn (18–40% Zn), бронза Cu–Sn (колокольная – 20% Sn), инструментальная бронза Cu–Zn–Sn (11% Zn, 3–8% Sn), мельхиор Cu–Ni–Mn–Fe (68% Cu, 30% Ni, 1% Mn, 1% Fe).
Нахождение металлов в природе и способы получения.Вследствие высокой химической активности, металлы в природе находятся в виде различных соединений, и только малоактивные (благородные) металлы – платина, золото и т.п. – встречаются в самородном (свободном) состоянии.
Наиболее распространенными природными соединениями металлов являются оксиды (гематит Fe2O3, магнетит Fe3O4, куприт Cu2O, корунд Al2O3, пиролюзит MnO2 и др.), сульфиды (галенит PbS, сфалерит ZnS, халькопирит CuFeS, киноварь HgS и т.д.), а также соли кислородосодержащих кислот (карбонаты, силикаты, фосфаты и сульфаты). Щелочные и щелочноземельные металлы встречаются преимущественно в виде галогенидов (фторидов или хлоридов).
Основная масса металлов получается путем переработки полезного ископаемого – руды. Поскольку металлы, входящие в состав руд, находятся в окисленном состоянии, то их получение осуществляется путем реакции восстановления. Предварительно руду очищают от пустой породы
Образовавшийся концентрат оксида металла очищают от воды, а сульфиды для удобства последующей переработки переводят в оксиды путем обжига, например:
2ZnS + 2O2 = 2ZnO + 2SO2.
Для разделения элементов полиметаллических руд пользуются методом хлорирования. При обработке руд хлором в присутствии восстановителя образуются хлориды различных металлов, которые вследствие значительной и различной летучести могут быть легко отделены друг от друга.
Восстановление металлов в промышленности осуществляется посредством различных процессов. Процесс восстановления безводных соединений металлов при высоких температурах называют пирометаллургией. В качестве восстановителей используют металлы более активные, чем получаемый, либо углерод. В первом случае говорят о металлотермии, во втором – карботермии, например:
Ga2O3 + 3C = 2Ga + 3CO;
Cr2O3 + 2Al = 2Cr + Al2O3;
TiCl4 + 2Mg = Ti + 2MgCl2 .
Особое значение углерод приобрел как восстановитель железа. Углерод для восстановления металлов применяется обычно в виде кокса.
Процесс восстановления металлов из водных растворов их солей относится к области гидрометаллургии. Получение металлов осуществляется при обычных температурах, причем в качестве восстановителей могут быть использованы сравнительно активные металлы или электроны катода при электролизе. Электролизом водных растворов солей могут быть получены только сравнительно малоактивные металлы, расположенные в ряду напряжений (стандартных электродных потенциалов) непосредственно перед водородом или после него. Активные металлы – щелочные, щелочноземельные, алюминий и некоторые другие, получают электролизом расплава солей.
Лекция 16. ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Органическая химия, наука, изучающая соединения углерода с др. элементами (органические соединения), а также законы их превращений. Название органическая химия возникло на ранней стадии развития науки, когда предмет изучения ограничивался соединения углерода растительного, и животного происхождения. Не все соединения углерода классифицируются как органические. Условно можно считать, что прототипом органического соединения является метан СН4.
К настоящему времени число известных органических соединений превышает 10 млн. и увеличивается каждый год на 250-300 тыс. Многообразие органических веществ определяется уникальной способностью атомов углерода соединяться друг с другом простыми и кратными связями, образовывать соединения с практически неограниченным числом атомов, связанных в цепи, циклы, бициклы, трициклы, полициклы, каркасы и др., образовывать прочные связи почти со всеми элементами периодической системы, а также явлением изомерии - существованием разных по свойствам веществ, обладающих одним и тем же составом и молекулярной массой.
Теория строения органических соединений (А.М.Бутлеров, 1861 год), базируется на трех основных положениях.
1. Атомы в молекулах соединяются в соответствии с их валентностью.
2. Свойства соединений зависят не только от их состава, но и от порядка связи атомов в молекуле, т.е. от их строения.
3. Атомы в молекуле взаимно влияют друг на друга.
Наглядным доказательством этих закономерностей служит явление изомерии. Изомерами называют соединения одинакового состава и молекулярной массы, отличающиеся по своим свойствам. Все изомеры делятся на два типа: структурныеи пространственные.Рассмотрим виды структурной изомерии.
Изомерия углеродного скелета.Наблюдается в том случае, когда два соединения одинакового состава отличаются только порядком соединения атомов углерода в молекуле.
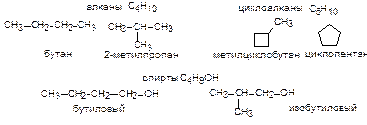
Межклассовая изомерия. Наиболее яркий пример структурной изомерии, при котором два изомера относятся к разным классам органических соединений.
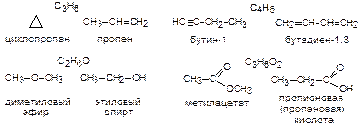
Изомерия положения кратной связи и функциональной группы. Наблюдается при различном расположении кратных связей и функциональных групп в одинаковом углеродном скелете.
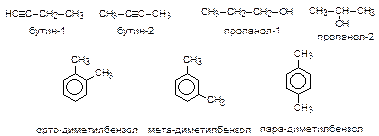
Пространственная изомерияопределяется различным относительным расположением групп в пространстве при одинаковой последовательности соединения атомов и подразделяется на геометрическуюи оптическую.
Геометрическая изомерияобычно обусловлена отсутствием свободного вращения вокруг двойной связи. При этом одинаковые заместители могут располагаться по одну (цис-) или по разные (транс-) стороны плоскости двойной связи.
Аналогичная изомерия относительно плоскости цикла возможна и для циклоалканов.
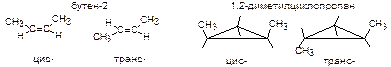
Оптическая (зеркальная) изомерия наблюдается в том случае, если в молекуле имеется sp3-гибридизованный атом углерода, имеющий четыре разных заместителя. Такой атом называется асимметрическим (обозначается С*). Молекула, содержащая такой атом, несовместима со своим зеркальным отражением, например:
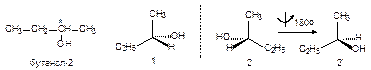
Молекулу и ее отражение называют зеркальными (оптическими) изомерами, а вещество оптически активным. Если через слой такого вещества пропустить луч плоско-поляризованного света, то плоскость поляризации повернется на определенный угол. Оба зеркальных изомера вращают плоскость поляризации света на одинаковый угол, но в разные стороны.
Реакции органических соединений имеют некоторые специфические особенности. В реакциях неорганических соединений обычно участвуют ионы; эти реакции протекают очень быстро, иногда мгновенно при нормальной температуре. В реакциях органических соединений обычно участвуют молекулы или атомы, при этом одни ковалентные связи разрываются, а другие образуются. Такие реакции протекают медленнее ионных (например, десятки часов), и для их ускорения часто требуется повысить температуру или добавить катализатор. Обычно протекает не одна, а несколько реакций, так что выход нужного продукта очень часто составляет менее 50%.
Классификация органических соединений.Основу классификации органических соединений составляет незамкнутая (открытая) или замкнутая цепь углеродных атомов; одно или несколько звеньев цепи могут быть заменены на атомы, отличные от углерода, так называемые гетероатомы, чаще всего О, N, S. По структуре органические соединения подразделяют на алифатические соединения - углеводороды и их производные, имеющие открытую углеродную цепь; карбоцикличиские соединения с замкнутой углеродной цепью; гетероциклические соединения. Углеводороды и их производные, не содержащие кратных связей, относятся к насыщенным соединениям, с кратными связями - к ненасыщенным.
Алканаминазываются предельные (насыщенные) углеводороды, содержащие только простые связи С-С. Общая формула алканов CnH2n+2. Алканы с числом атомов углерода больше четырех имеют скелетные изомеры. Разветвленные предельные углеводороды рассматривают как алканы, в которых некоторые атомы водорода замещены на радикалы. Любые алканы сгорают до углекислого газа и воды с выделением большого количества тепла, например:
C5H12 + 8O2 ® 5CO2 + 6H2O.
Крекинг.Процесс, проходящий при высокой температуре, давлении и обычно в присутствии катализаторов. Результатом крекинга является смесь алканов и алкенов с меньшей длиной цепи, чем у исходного алкана.
Циклоалканы.Общая формула класса СnH2n, т.е. циклоалканы изомерны алкенам. Названия образуют прибавлением приставки цикло- к названию соответствующего алкана.
Техническое применение алканов и циклоалканов.Алканы применяют главным образом в составе моторных и реактивных топлив. Хлорпроизводные метана и этана используют в качестве растворителей, твердые (парафин, церезин) - в производстве пластмасс, каучуков, синтетических волокон, моющих средств, а также в пищевой промышленности, электро- и радиотехнике. Циклогексан используется в качестве растворителя эфирных масел, восков, лаков, красок и др.
Углеводороды, содержащие двойную связь С=С, называются алкенамиили этиленовыми углеводородами. Общая формула класса - СnH2n. Алкены с числом атомов углерода менее пяти - газы. Алкены нерастворимы в воде, но растворяются в неполярных растворителях. Для алкенов характерны реакции полимеризация:
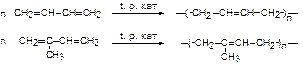
Последним способом получают искусственные (синтетические) каучуки.
Алкины - углеводороды, содержащие в своем составе тройную связь. Общая формула - CnH2n-2. Молекулы алкинов имеют линейное строение благодаря sp-гибридизации атомов углерода, связанных тройной связью.
Техническое применение алкенов и алкинов.Алкены и алкины широко применяют в химической промышленности для получения полиэтилена, полипропилена, различных каучуков, уксусной кислоты, винилхлорида и др. Ацетилен используется для сварки черных металлов.
Арены- углеводороды, в состав которых входят циклы из шести атомов углерода, содержащие по три сопряженные двойные связи. Простейшим ареном является бензол С6Н6.
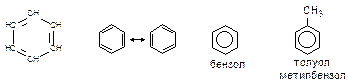
Техническое применение аренов. Ароматические соединения являются важными промежуточными и целевыми продукты промышленности органического синтеза.
Спирты - органические соединения, в молекулах которых содержится одна или несколько гидроксильных групп (-ОН), соединенных с углеводородным радикалом. По месту гидроксильной группы в цепи спирты делятся на:

В зависимости от числа гидроксильных групп спирты делятся на:
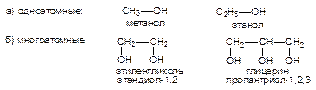
В зависимости от характера углеводородного радикала, связанного с гидроксильной группой, спирты делятся на алифатические и ароматические. Все одноатомные спирты бесцветны, легче воды. Спирты с числом атомов углерода меньше двенадцати - жидкости. Температуры их кипения аномально высоки благодаря межмолекулярным водородным связям. Метанол, этанол и пропанол неограниченно растворимы в воде. Все гликоли - вязкие жидкости.
Фенол(карболовая кислота - С6Н5ОН) обладает бактерицидным, раздражающим, прижигающим действием. Это первый антисептик, примененный в хирургии. Большинство фенолов - кристаллические вещества с невысокой температурой плавления, малорастворимы в воде.
Альдегиды и кетоны (карбонильные соединения, оксосоединения) -производные углеводородов, содержащие карбонильную группу >C=O.
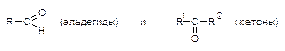
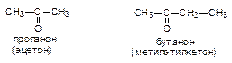
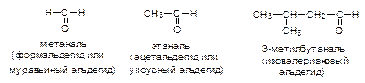
Формалин (40 % водный раствор формальдегида) применяется для дезинфекции, а также консервирования анатомических препаратов.
Карбоновыми кислотами называют органические соединения, содержащие в своем составе карбоксильную группу:
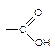
|
По числу карбоксильных групп делятся на монокарбоновые (одноос-новные) и дикарбоновые (двухосновные), в зависимости от строения углеводородного скелета - на алифатические (уксусная, щавелевая) и ароматические (бензойная). Предельные одноосновные карбоновые кислоты, содержащие от одного до одиннадцати атомов углерода - жидкости, хорошо смешивающиеся с водой. В твердом и жидком состояниях, а также в водных растворах молекулы молекулы кислот димеризуются в результате образования между ними водородных связей.
Техническое применение спиртов, альдегодов, кетонов и органических кислот. Применяют спирты как полупродукты в синтезе различных органических соединений, в производстве красителей, синтетических волокон, моющих средств. Спирты используют как растворители. Метиловый спирт используется в качестве моторного топлива. Среди спиртов наиболее токсическим действием обладает метанол (смертельная доза 100-150 мл).
Альдегиды применяют для получения спиртов, карбоновых кислот и их производных и полимеров. Альдегиды раздражают слизистые оболочки глаз и верхних дыхательных путей, вредно влияют на нервную систему.
Кетоны (например, ацетон) используются в качестве растворителей.
Карбоновые кислоты исходные соединения для получения промежуточных продуктов органического синтеза, в частности кетенов, галогенангидридов, виниловых эфиров, галогенкислот. Соли карбоновых кислот и щелочных металлов применяют как мыла, эмульгаторы, смазочные масла; соли тяжелых металлов - сиккативы, инсектициды и фунгициды, катализаторы. Эфиры карбоновых кислот – растворители, пластификаторы, компоненты лаков и алкидных смол и пластмассы.
Cложные эфиры- производные органических или кислородсодержащих неорганических кислот, у которых атом водорода замещен на углеводородный радикал.
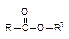
Простейшие по составу сложные эфиры бесцветные легкокипящие жидкости с фруктовым запахом; высшие сложные эфиры воскообразные вещества. Все сложные эфиры в воде растворяются плохо.
Жиры (триглицериды) - сложные эфиры глицерина и высших карбоновых (жирных) кислот. Наиболее часто в состав жиров входят предельные (пальмитиновая С15H31COOH, стеариновая С17H35COOH) и непредельные кислоты (олеиновая C17H33COOH, линолевая C17H31COOH, линоленовая С17H29COOH). Природные жиры представляют собой смесь различных триглицеридов:
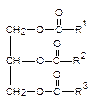
|
Жиры - вязкие жидкости или твердые вещества, легче воды, в воде не растворяются, но растворяются в органических растворителях. Жиры, образованные предельными кислотами - твердые вещества, а непредельными - жидкие (они называются маслами). Чем больше в жирах содержание непредельных кислот, тем ниже их температура плавления.
Техническое применение сложных эфиров и жиров. Сложные эфиры используются в качестве растворителей, пластификаторов в производстве пластических масс и полимеров, присадок к маслам. Жиры используются в качестве компонентов смазочных масел.
Амины класс органических соединений, содержащих атом азота и имеющих общие формулы RNH2, R2NH, R3N, где R углеводородный радикал. Амины можно рассматривать как органические производные аммиака, в которых один или несколько атомов водорода замещены на углеводородные радикалы. По природе радикала их делят на алифатические и ароматические. В зависимости от степени замещенности различают первичные, вторичные и третичные амины, причем строение радикала значения не имеет.
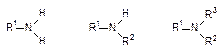
Техническое применение аминов. Амины применяются в качестве ингибиторов коррозии. Амины поражают нервную систему,
Гетерофункциональные соединения это соединения, содержащие в своем составе несколько различных функциональных групп (гидроксокислоты, углеводы, хлорорганические кислоты, например хлоруксусная кислота). Примером гетерофункционального соединения являются аминокислоты.
Аминокислотыэто класс органических соединений, содержащих одновременно аминогруппу (-NH2) и карбоксильную группу (-COOH).
Названия аминокислот строятся из названия соответствующей карбоновой кислоты с прибавлением приставкиамино- и указанием положения аминогруппы. При этом атомы углерода часто обозначаются буквами греческого алфавита по мере удаления от карбоксильной группы (a-, b-аминокислоты).
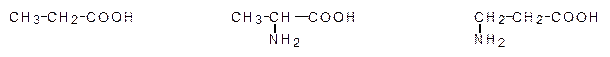
пропановая кислота a-аминопропановая к-та b-аминопропановая к-та
2-аминопропановая к-та 3-аминопропановая к-та
Важнейшие природные аминокислоты являются a-аминокислотами. Для них обычно используют исторически сложившиеся тривиальные названия.
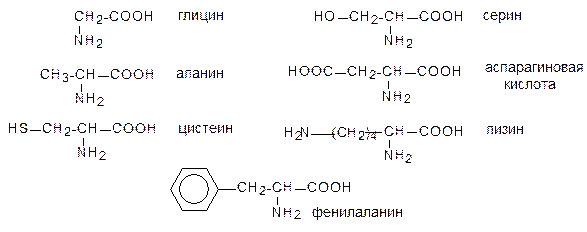
В растворе молекула аминокислоты в зависимости от рН может находиться в трех состояниях. Например, молекула глицина в щелочной среде в виде аниона NH2CH2COO¯, в кислой среде в виде катиона NH3+CH2COOH и при некотором промежуточном значении рН, которое называется изоэлектрической точкой, в виде NH3+CH2COO¯. В последнем случае молекула не заряжена, но одна ее часть заряжена положительно, а вторая отрицательно.
Одновременное присутствие этих двух функциональных групп обеспечивает аминокислотам и ряд особенностей.
1) Амфотерность.
NH2CH2COOH + HCl ® [NH3CH2COOH]+Cl-
солянокислая соль глицина
(гидрохлорид глицина)
NH2CH2COOH + NaOH ® NH2CH2COONa + H2O
натриевая соль глицина
(аминоацетат натрия)
2) Конденсация аминокислот. Межмолекулярная конденсация служит основой образования важнейших биомолекул пептидов и белков:

аланин глицин аланилглицин
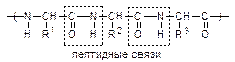
Полимеры (высокомолекулярные соединения)характеризуются молекулярной массой от нескольких тысяч до нескольких миллионов. Любые атом или группа атомов, входящие в состав цепи полимера или олигомера, называют составным звеном. По химическому составу макромолекулы различают гомополимеры (полимер образован из одного мономера, например полиэтилен) и сополимеры (полимер образован, по меньшей мере, из двух различных мономеров, например бутадиен-стирольный каучук).
Полимеризация - процесс последовательного соединения одинаковых молекул (мономеров) в более крупные (полимеры) по месту разрыва кратных связей. Структурное звено полимера - группа атомов, многократно повторяющаяся в макромолекуле полимера.
Особые свойства полимеров:
1) не имеют определенной температуры плавления, некоторые разлагаются ниже температуры плавления
2) не подвергаются перегонке, т.к. разлагаются при нагревании
3) не растворяются в воде (или растворяются с трудом)
4) обладают высокой прочностью
5) инертны в химических средах, устойчивы к воздействию окружающей среды.
Синтез полимеров осуществляется в ходе реакции полимеризации, поликонденсации, сополимеризации. В зависимости от строения углеродной цепи, различают линейные (неразветвленные), разветвленные и сетчатые (сшитые) полимеры.
 |
Примеры:
Фенол (в избытке) с формальдегидом в кислой среде образует термопластичные растворимые новолачные смолы линейного строения:
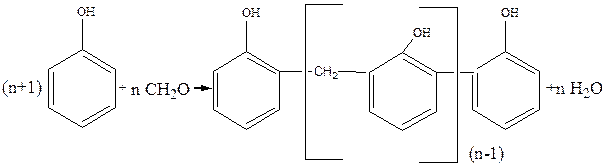
Относительная молекулярная масса новолачной смолы невелика: 1000–2000. Новолачные смолы плавки, растворимы; они применяются для приготовления лаков и прессовочных порошков.
В случаях поликонденсации фенола (без избытка) с формальдегидом в щелочной среде образуются резольные смолы (резолы):
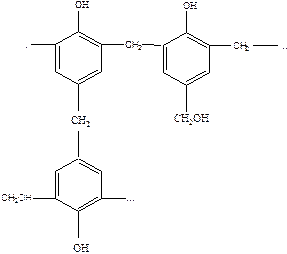
Резолы растворимы в органических растворителях, например, в этиловом спирте. При растворении резолов образуются так называемые бакелитовые лаки, клеи (например, клей БФ). Резолы термопластичны, при нагревании они размельчаются и могут формоваться. При хранении или нагревании резолов до 413°С в избытке формальдегида они превращаются в термореактивные резиты. Резиты не плавятся и ни в чем не растворяются. Это объясняется дальнейшей поликонденсацией макромолекул резольной смолы с выделением воды за счет метилольных групп и бензольных ядер.
Полиметилметакрилат – органическое стекло (плексиглас) – получается при полимеризации метилового эфира метакриловой кислоты (метилметакрилата) и представляет собой бесцветную прозрачную массу:
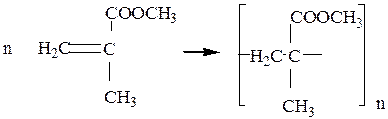
При 573 К полиметилметакрилат деполимеризуется с образованием исходного мономера метилметакрилата.
Техническое применение полимеров. Механическая прочность, эластичность, электроизоляционные и другие ценные технические свойства полимеров обусловливают их широкое применение в различных отраслях народного хозяйства и в быту. Высокомолекулярные соединения являются основой пластических масс, химических волокон, резины, лакокрасочных материалов, клеев и герметиков.
Дата добавления: 2015-08-26; просмотров: 1580;
