Понятие о термодинамических потенциалах
Наряду с энтропией используют ряд других, связанных с ней функций состояния системы. Наиболее важны из них:
1. 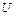 – внутренняя энергия;
– внутренняя энергия;
2. 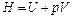 – энтальпия;
– энтальпия;
3. 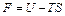 – свободная энергия (функция Гельмгольца);
– свободная энергия (функция Гельмгольца);
4. 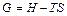 – функция Гиббса.
– функция Гиббса.
Данные функции состояния являются термодинамическими потенциалами. Это следует из того, что при равновесных процессах, в которых остаются постоянными некоторые из параметров системы, убыль термодинамических потенциалов равна совершаемой системой работе.
Покажем это, используя первое начало термодинамики 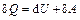 .
.
1. Внутренняя энергия 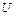 .
.
При адиабатическом процессе 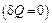 имеем:
имеем: 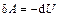 .
.
2. Энтальпия 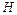 .
.
В самом общем случае совершаемую системой элементарную работу 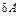 можно представить в виде:
можно представить в виде:
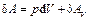 ,
,
где 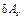 – работа, не связанная с изменением объема системы (например, работа против сил поверхностного натяжения, работа по перемещению зарядов в электрическом поле и т.д.).
– работа, не связанная с изменением объема системы (например, работа против сил поверхностного натяжения, работа по перемещению зарядов в электрическом поле и т.д.).
Тогда первое начало имеет вид:
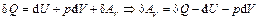 .
.
Отсюда при одновременном выполнении условий 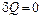 и
и 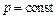 получим:
получим:
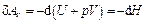 .
.
3. Свободная энергия 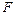 .
.
Для обратимых процессов: 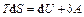 .
.
При 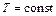 получим:
получим: 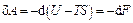 .
.
Тогда 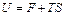 , т.е. внутреннюю энергию системы можно разделить на две части. Одна из них – свободная энергия – может быть превращена в работу при обратимом изотермическом процессе и в этом смысле является «свободной». Вторая, равная
, т.е. внутреннюю энергию системы можно разделить на две части. Одна из них – свободная энергия – может быть превращена в работу при обратимом изотермическом процессе и в этом смысле является «свободной». Вторая, равная 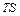 , в том же процессе не может быть превращена в работу и называется связанной энергией.
, в том же процессе не может быть превращена в работу и называется связанной энергией.
Для термодинамической системы, находящейся при постоянных температуре и объеме, 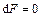 . При необратимом процессе
. При необратимом процессе 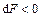 , т.е. свободная энергия может только убывать, поэтому условием равновесия такой системы будет условие минимума свободной энергии.
, т.е. свободная энергия может только убывать, поэтому условием равновесия такой системы будет условие минимума свободной энергии.
4. Функция Гиббса 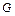 .
.
С учетом работы, не связанной с изменением объема системы:
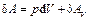 .
.
Тогда 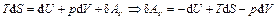 .
.
Отсюда при 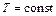 и
и 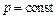 имеем:
имеем:
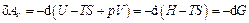 .
.
Зависимость давления насыщенного пара
от температуры
Чтобы проинтегрировать уравнение Клапейрона-Клаузиуса, найдём сначала зависимость теплоты испарения от температуры, т.е. L(T).
К состоянию пара при температуре Т от жидкости при температуре Т0 можно прийти двумя путями.
1-ый способ: испарить жидкость при температуре Т0 и нагреть пар при постоянном давлении до температуры Т. Затрачиваемая на 1 моль энергия равна:

2-ой способ: жидкость нагреть до Т, а затем испарить.
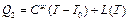
Начальные и конечные состояния в обоих способах одинаковы, поэтому 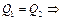
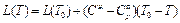
В уравнении Клапейрона-Клаузиуса можно пренебречь молярным объёмом жидкости по сравнению с молярным объёмом газа:
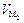 «
« 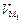 , где
, где 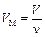 .
.
Кроме того, для пара предполагаем выполнение уравнения 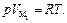
Тогда 
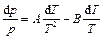 .
.
Таким образом, давление насыщенного пара для фазового перехода жидкость–газ определяется формулой:
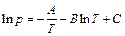 , где А, B, С – постоянные.
, где А, B, С – постоянные.
| <== предыдущая лекция | | | следующая лекция ==> |
| Лекция № 14. Бессознательное | | | ЗОНУВАННЯ ЗЕМЕЛЬ |
Дата добавления: 2015-08-26; просмотров: 1021;
