Сохранение in vitro генофонда
1 В настоящее время осуществляется создание новых сортов растений и регулярная смена, что связано, в первую очередь, с утратой сортом ценных признаков, появлением новых популяций вредителей и возбудителей болезней, изменением климата, почвы и множеством других причин. Средний срок жизни сорта пшеницы и других зерновых культур обычно 5-10 лет. Для выведения новых сортов и улучшения старых требуется разнообразный генетический материал. В целях сохранения генофонда редких и исчезающих видов, ценных селекционных объектов и штаммов - продуцентов экономически важных веществ разрабатываются методы создания коллекций и банков генов in vitro.
Основным источником генов являются семена. Для создания новых клеточных линий. синтезирующих ценные продукты, необходимо хранение коллекции клеток, то есть эталонов клеток-продуцентов, обладающих определенными характеристиками. Для исследования физиологических и биохимических процессов в культивируемых клетках возникает необходимость длительного сохранения исходных стандартных линий клеток. Таким образом, для решения задач требуются методы хранения культуры клеток. Есть два подхода в решении данной проблемы: замедление роста клеток и хранение в замороженном состоянии, то есть криосохранение (от греч. kгyos - «мороз», «лед»). Задача состоит в том, чтобы изменить кинетику роста культуры и увеличить время между пересадками. Это позволило бы пересаживать культуры раз в 3-4 месяца, год и даже реже. В настоящее время замедление роста под влиянием факторов, ограничивающих рост, достигнуто лишь для культур побегов и растений-регенерантов.
Наиболее действенный путь замедления роста состоит в снижении температуры культивирования в сочетании с пониженным освещением. Выбор температуры определяется холодостойкостью вида растения. Так, для депонирования коллекций картофеля использовалась температура 10 оС, а яблони 1 оС. Рекомендуют для культур, нормально растущих при 20 – 25 оС, использовать 4-10 оС.
Рост растения можно также замедлить добавлением к питательной среде осмотиков - маннита и сорбита, повышением концентрации сахарозы или внесением в питательную среду веществ, тормозящих рост. В качестве последних были использованы гидразид малеиновой кислоты, 2,2-метилгидразид янтарной кислоты, хлорхолинхлорид, абсцизовая кислота. В крайне редких случаях для замедления роста используют снижение содержания кислорода - гипоксию. Условия гипоксии создают применяя смесь 90% азота и 10% кислорода. Иногда уменьшают концентрацию кислорода и одновременно снижают атмосферное давление. Во избежание истощения питательных веществ и обезвоживания объем агаризованной среды для медленно растущих культур увеличивают. Если используется жидкая питательная среда, ее время от времени доливают, поскольку она активнее испаряется.
2 Криосохранение- это глубокое замораживание и хранение при сверхнизких температурах, например при температуре жидкого азота (-196°С). Такая температура гарантирует стабильное сохранение генетических характеристик объектов практически в течение любого срока. Данный метод позволяет хранить самый разнообразный материал - от изолированных протопластов до зародышей и семян. В настоящее время глубокое замораживание клеток, тканей и органов получило широкое распространение в медицине и животноводстве. Иначе обстоит дело с растительным материалом. Главные трудности связаны со спецификой растительных клеток и с самим процессом глубокого замораживания. Растительные клетки, имеющие большие размеры, большие вакуоли и много воды, сильнее повреждаются при замораживании и последующем оттаивании. Повреждение клеток связано с образованием льда как внутри клеток, так и снаружи. Лед обычно образуется сначала во внешнем растворе вокруг клеток. Точка замерзания цитоплазмы минус 1 оС, но клетки остаются не замерзшими до -10-15 оC, так как до этого плазмалемма еще предотвращает проникновение внутрь кристаллов льда, растущих во внешнем растворе. Рост кристаллов льда внутри клетки разрушает ее мембраны.
Если температура снижается медленно, токлетка успевает потерять часть свободной воды, которая выходит из нее и замерзает на поверхности медленно растущих кристаллов во внешнем растворе. Очень быстрое замораживание не сопровождается дегидратацией и приводит к возникновению кристаллов льда в цитоплазме. Медленное замораживание может полностью исключить кристаллизацию воды в клетке, но при этом неизбежно происходит значительная дегидратация и сжатие протоплазмы. Обезвоживание клетки происходит вследствие концентрирования внешнего раствора из-за образования в нем льда. Чрезмерный плазмолиз и вызванный им осмотический стресс (особенно при последующем деплазмолизе) приводит клетку к гибели.
Таким образом, причиной гибели клеток при замораживании является образование льда внутри клетки и механическое повреждение ее мембран, а также осмотический стресс, обусловленный сильным обезвоживанием клетки. Следовательно, все приемы, используемые в криосохранении, направлены на определенную сбалансированность обоих повреждающих факторов. Выживание клеток растений зависит от целого ряда условий: генетических и морфофизиологических их особенностей и способности к холодовому закаливанию, состава и количества природных или искусственно добавляемых криопротекторов, уровня проницаемости этих веществ и воды, скорости снижения температуры и условий оттаивания.
Работа по криосохранению культуры клеток состоит из следующих этапов (рис.18): - подготовка культуры клеток,
- добавление криопротектора,
- программное замораживание,
- хранение в жидком азоте,
- быстрое оттаивание,
- удаление криопротектора,
- рекультивирование и регенерация растений.
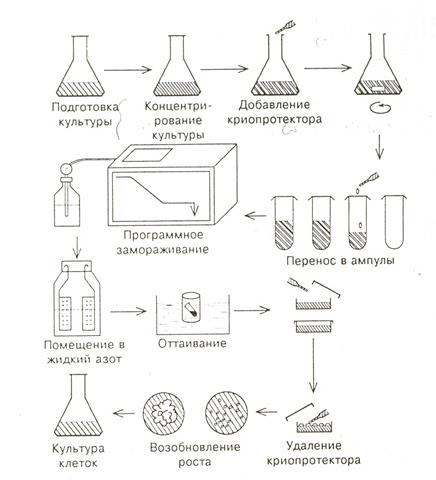
Рисунок 18. Этапы криосохранения культуры клеток
Дата добавления: 2015-07-14; просмотров: 3023;
