Особенности строения силикатов
Силикатами являются почти все породообразующие минералы, составляющие около ½ массы земной коры, а также искусственно получены продукты – керамика, стекло, цемент.
Они представляют собой особый класс неорганических соединений, основной структурной единицей которых являются изолированные или связанные между собой кремнекислородные группы [SiO4]4-. Отношение радиусов кремния и кислорода в ортосиликатной группе составляет 0,37, что соответствует координационному числу 4. Координационным многогранником является тетраэдр, в котором катион кремния устойчиво координирован (окружен) четырьмя анионами кислорода (рис. 12.1).
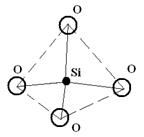
Рисунок 12.1 – Кремнекислородный радикал [SiO4]4-
Единичная связь Si – O является промежуточной между ионной и ковалентной. Процент доли ковалентной связи, вычисленной по отношению электроотрицательностей ионов Si4+ и О2-, составляет примерно 50%. Связь Si – O обладает относительно большой прочностью, она равна 470 кДж/моль.
Тетраэдрические группы [SiO4]4- объединяются друг с другом через общие (мостиковые) ионы кислорода, нейтрализуя валентности последних. Такое объединение может происходить только путем обобщения вершин тетраэдра, а не ребер и граней (т.е. у двух соседних тетраэдров общим может быть только один анион кислорода). В зависимости от количества обобщенных вершин (одна, две, три или четыре), создаются различные кремнекислородные комплексы, они носят название кремнекислородного мотива и на их характере основывается современная классификация структуры силикатов.
Кроме кремнекислородных комплексов в состав силикатов входит много других ионов: Li, Na, K, Be, Mg, Ca, Ti, Zr, Mn, Fe, Zn, B, Al, Ba, O, H, F и др. Роль этих компонентов заключается в том, что они компенсируют валентности немостиковых анионов кислорода и соединяют кремнекислородные группировки между собой, как бы «сшивая» их.
Некоторые из этих катионов, прежде всего Al, В, Be обладают способностью частично замещать кремний в кремнекислородном мотиве. В результате такого изоморфного замещения образуются смешанные мотивы, например алюмокремнекислородный, а также боро-, берилло-, титано- и цирконокремнекислородные.
Особенно интересна и важна в силикатах роль алюминия и бора. Ион алюминия крупнее иона кремния, поэтому в силикатах алюминий может встречаться по отношению к кислороду как в тетраэдрической координации (в этом случае он замещает кремний в кремнекислородном мотиве, - алюмосиликаты), так и в октаэдрической (в этом случае он находится вне кремнекислородного мотива, - силикаты алюминия).
В силикатные кремнекислородные мотивы могут входить и некоторые катионы F-, (oh)- и нейтральные молекулы воды Н2О, замещая ионы кислорода. Причем не все анионы кислорода обязательно входят в кремнекислородный мотив.
Катионы щелочных (Li, Na, K), щелочно-земельных (Mg, Ca, Ba), переходных металлов (Ti, Zr, Mn, Fe) в кремнекислородные мотивы не входят. Они нейтрализуют валентности необобществленных (активных) анионов кислорода в кремнекислородном мотиве и связывают кремнекислородные радикалы между собой.
Обычным координационным числом для большинства металлов (Li, Mg, Ca, Ti, Sr, Mn, Fe) по кислороду является 6, а координационным многогранником – октаэдр. Тетраэдрическая координация в силикатах встречается у Ti, Zr, Fe. Размеры таких тетраэдров значительно превышают размеры кремнекислородных, поэтому эти элементы, как правило, не входят в кремнекислородные мотивы. Крупные и одновалентные катионы (Na, K) могут иметь в силикатах структурный тип корунда (тип Д5), координационное число по кислороду, равное 8 и больше.
Одной из особенностей структур силикатов является тот факт, что большинство из них не образуют плотнейших упаковок. Связано это, в частности, с низким координационным числом кислорода по кремнию (анион кислорода координируется только двумя катионами Si4+). Исключением является форстерит 2MgO·SiO2.
Дата добавления: 2015-06-27; просмотров: 3760;
