Примеры основных структурных типов
Структурный тип меди (тип А)
В данном структурном типе кристаллизируются многие металлы: Au, Ag, Ni, Al, Ca, Pb и др.
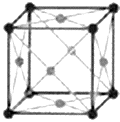
|
| Рисунок 11.1 – Кристаллическая решетка меди |
Элементарная ячейка меди – кубическая гранецентрированная (ГЦК- рис. 11.1). Атомы располагаются в вершинах и центрах граней. На одну ячейку приходится четыре атома (1/8×8+1/2×6=4). Каждый атом окружен двенадцатью ближайшими атомами (к.ч.=12, координационный многогранник кубоктаэдр). Плотнейшая упаковка обнаруживается перпендикулярно осям L3 и соответствует кубической плотнейшей упаковки (АВС//АВС).
Описывая структуру, например Аl, можно сказать, что он имеет структурный тип меди, а его межплоскостное расстояние равно: d=0,286 нм. Этого описания достаточно для полной характеристики кристаллической решетки алюминия.
Структурный тип магния (тип А3)
В данном структурном типе кристаллизуются гексагональные металлы: Cd, Be, Ni, Cr.
|
| Рисунок 11.2 – Кристаллическая решетка магния |
Элементарная ячейка магния - гексагональная примитивная (рис. 11.2).
Атомы расположены в вершинах ячейки, а также в центрах трех из шести тригональных призм (если мысленно разделить гексагональную призму на шесть тригональных).
Каждый атом магния окружен двенадцатью ближайшими атомами: шесть в том же слое, три в соседнем слое сверху и три - в соседнем слое снизу, то есть к.ч.=12, что служит признаком плотнейшей упаковки. Координационный многогранник – гексагональный кубоктаэдр. Плотнейшая гексагональная упаковка (двухслойная АВ//АВ) – перпендикулярна оси L6.
В идеальных, плотно упакованных гексагональных металлах отношение высоты элементарной ячейки с к расстоянию а между соседними атомами в базисной плоскости с/а = 1,663, хотя сами параметры с и а для разных веществ различны.
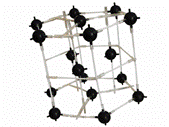
Структурный тип железа (тип А2)- рис. 11.3.
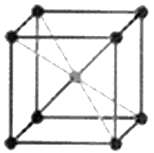
|
| Рисунок 11.3 – Кристаллическая решетка железа |
К данному типу (тип ОЦК-металлов) относятся тугоплавкие металлы: W, Cr, Mo, Co, V, ниобий, тантал.
Причем a-Fe имеет структуру ОЦК в области температуры ниже 910о и выше 1400оС, а в области 910-1400оС оно имеет ГЦК – структуру.
Элементарная ячейка – обьемоцентрированный куб, Z=1/8×8+1=2 атома. ОЦК - структура не имеет плотнейшей упаковки.
Структурный тип алмаза (тип А4)
Кристаллизуются важнейшие элементарные полупроводники, элементы IV групп периодической системы: германий, кремний, серое олово (a).
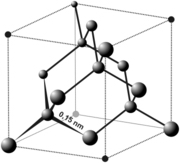
|
| Рисунок 11.4 – Кристаллическая решетка алмаза |
Тип ячейки Бравэ - гранецентрированная кубическая (ГЦК- рис. 11.4). Атомы углерода занимаю все узлы ГЦК – ячейки, а также центры половины октантов, на которые можно разбить куб тремя взаимно-перпендикулярными плоскостями, причем заполненные и незаполненные октанты чередуются в шахматном порядке.
Все связи в структуре алмаза направлены по <111> (т.е. по вершинам тетраэдра) и составляют друг с другом углы 109о28’ (кстати, у кремния этот угол такой же), d алмаза=0,375 нм, (d кремния=0,543 нм). Каждый атом окружен четырьмя такими же атомами, т.е. координационное число равно четырем, координационный многогранник - тетраедр.
На одну элементарную ячейку приходится восемь атомов (Z=1/8×8+1/2×6+4=8).
Плотнейшей упаковки в структуре нет. Однако в направлении перпендикулярно оси L3 есть плоскости, упакованные плотнее, чем любые другие плоскости. Эти слои двойные, как бы слагаются из двух подслоев: один состоит из атомов, у которого вертикально расположенные связи направлены вверх, а у другого - вниз. В подслоях три связи на атом, а два соседних двойных слоя одной соединяются одной связью на атом. По ним проходит спайность алмаза.
В структуре существуют шестисторонние «каналы» в направлениях <110> (диагонали в грани куба) проходящие насквозь. По этим каналам легко идет диффузия примесей в кристаллическую решетку, которые окрашивают алмаз.
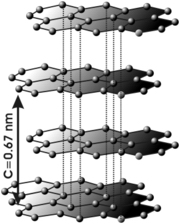
Структурный тип графита (тип А9) рис. 11.5.
Гексагональная модификация углерода термодинамически устойчивая при температуре ниже 1000оС.
|
| Рисунок 11.5 – Кристаллическая решетка алмаза |
Структура графита состоит из параллельных слоев, в которых атомы углерода располагаются в вершинах правильных шестиугольников (гексагонов). Каждый слой смещен по отношению к двум соседним, точно повторяющим друг друга, на половину большой диагонали гексагона. Координационное число равно трем, координационный многогранник - треугольник.
Элементарная ячейка – ромбическая призма. Атомы расположены в вершинах, середине всех длинных ребер, в центре одной тригональной призмы и в основаниях второй: Z=1/8×8+1/4×4+1/2×2+1=4.
Упаковка не плотнейшая. Расстояние между слоями в структуре значительно больше (3,40 Å = 0,340 нм), чем расстояние между атомами внутри слоя (1,40Å = 0,140 нм). Внутри слоя действуют прочные ковалентные связи, между слоями – слабые Ван-дер-Ваальсовские. Этим объясняется сильное различие свойств вдоль и поперек главной оси симметрии. Электропроводность вдоль оси С в 105 раз больше, чем в поперечных направлениях. Весьма совершенная спайность по (0001).
|
| Рисунок 11.6 – Кристаллическая решетка NaСl |
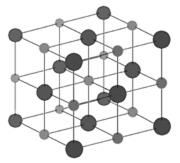
Структурный тип NaСl ( тип В1)
Среди бинарных соединений типа АВ – наиболее распространен: хлориды, фториды, бромиды, йодиды Li, Na, K; оксиды Mg, Ca, Sr, Ba, Cd, Mn, Fe, Co, Ni (т.е. переходных элементов), сульфиды, селениды Ca, Sr, Ba, Pb, Mn.
Структуру можно описать как две кубические гранецентрированные решетки ионов Na и Сl (рис. 11.6), сдвинутых одна относительно другой так, что узел [[000]] одной ячейки совпадает с узлом [[½, ½, ½]] другой ячейки.
Координационное число NaCl = ClNa = 6, координационный многогранник – октаэдр.
Можно сказать, что здесь взаимопроникающие упаковки: одна из атомов хлора, другая – из атомов натрия. Анионы хлора образуют кубическую плотнейшую упаковку, а катионы натрия заполняют все октаэдрические пустоты.
ZNaСl = 4.
Спайность по кубу.
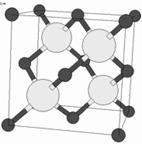
Структурный тип сфалерита ( тип В3 )
Кубический сфалерит – цинковая обманка a- ZnS.
|
| Рисунок 11.7 – Кристаллическая решетка сфалерита |
Сходен со структурой алмаза: это - ГЦК решетка, в которой заселена половина тетраэдрических пустот. Заселенные октанты чередуются с незаселенными в шахматном порядке. Отличие от структуры алмаза заключается в том, что в алмазе все атомы одинаковы, а в сфалерите атомы одного сорта (например, серы) занимают узлы ГЦК ячейки, а другого (например, цинка) - центры четырех октантов (рис. 11.7). Структуру сфалерита можно описать как две ГЦК – решетки, смещенные относительно друг друга на четверть телесной диагонали кубической ячейки, или как плотнейшую упаковку ионов серы, смещенную на такое же расстояние от аналогичной упаковки ионов цинка.
Координационное число Zn/S= S/Zn = 4, координационный многогранник – тетраэдр; ZZnS = 4.
В этой структуре (также как и в структуре вюрцита b-ZnS) нет центра симметрии, эти структуры полярны, т.е. в них возможны полярные физические свойства. Это могут быть полупроводники, пьезоэлектрики.
По типу сфалерита кристаллизуются AgI, CuCl, SiC, HgS, SiC и др.
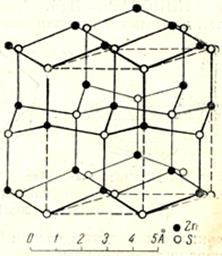
Структурный тип вюртцита (тип В4)
|
| Рисунок 11.8 – Кристаллическая решетка вюртцита |
b-ZnS - гексагональная модификация, метастабильная при обычных условиях. Ось L6 является не только полярным, но и единичным направлением, поэтому анизотропия физических свойств высокая.
Элементарную ячейку вюртцита можно представить в виде двух тригональных призм, составленных в ромбическую призму с g=120о. Внутри одной из призм нет ионов, а в другой - на линии, соединяющей центры ее оснований, есть по одному катиону и аниону. Кроме того, анионы расположены по вершинам ромбической призмы, а катионы - по ребрам.
ZZnS=2, координационные числа Zn/S= S/Zn =4.
Можно также описывать такую структуру гексагональной призмой, составленной из шести элементарных тригональных призм.
Плотнейшая упаковка в структуре вюртцита образована параллельными слоями анионов, катионы заполняют половину тетраэдрических пустот. Нужно заметить, что оба вида ионов образуют гексагональную плотнейшую упаковку.
По типу вюртцита кристаллизуются ZnО, CdS, BeO.
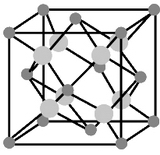
|
| Рисунок 11.9 – Кристаллическая решетка вюртцита |
Структурный тип флюорита (тип С1)
Ионы кальция – по узлам ГЦК, ионы фтора – в центрах каждого октанта.
ZCa=4, ZF=8 ZCaF2= 4
Координационное число Ca/F=8, F/Ca=4.
Координационные многогранники: куб, тетраэдр.
Ионы кальция образуют плотнейшую кубическую упаковку, в которой ионы фтора располагаются в тетраэдрических пустотах. Эта структура характерна для некоторых галоидов BaF2, двуокисей UO2, ThО2.
Антифлюоритовый тип структуры - геометрически подобен флюоритовому, но в нем места катионов занимают анионы, а анионов - катионы. Такую структуру имеют многие соединения типа А2В (аргентин Ag2S, халькозин Cu2S).
Структурный тип рутила ТіО2 (типС4)

|
| Рисунок 11.10 – Кристаллическая решетка рутила |
Кристаллизуется в тетрагональной сингонии, имеет элементарную ячейку в виде обьемоцентрированного прямоугольного параллелепипеда (рис. 11.10), в вершинах и центре которого располагаются ионы Ті4+.
Координационное число Ti/О=6, O/Ti=3.
Координационные многогранники: октаэдр, треугольник.
В направлении оси L4 октаэдры, соединяясь друг с другом ребрами, образуют цепочки, следствием чего является характерный длиннопризматический, до игольчатого облик кристаллов рутила, вытянутых по оси С.
Структуру рутила имеют касситерит SnO2, полианит MnO2, платтенерит PbO2.
Структурный тип корунда (тип Д5) рис. 11.11.
Структуру корунда можно описать как ромбоэдрически деформированную структуру NaCl, в которой ион Na или Cl заменен группой Al2O3.
Двухвалентные ионы кислорода образуют гексагональную плотнейшую упаковку, а трехвалентные ионы алюминия заполняют 2/3 октаэдрических пустот, лежащих в направлениях <1010>. Корунд кристаллизуется в тригональной сингонии.
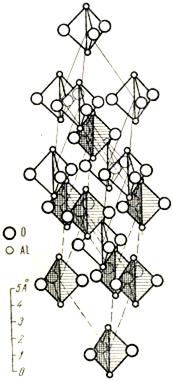
|
| Рисунок 11.11 – Кристаллическая решетка корунда |
Плотнейшая упаковка несколько деформируется из-за большого электростатического притяжения между катионами алюминия и анионами кислорода.
В тоже время, сильное электростатическое притяжение, наряду с плотной упаковкой, обусловливает высокую твердость корунда (самый твердый после алмаза).
Чистые кристаллы корунда бесцветны. Примеси, которые легко входят в структуру, окрашивают корунд в разные цвета: хром – от бледно-розового до темно-красного (рубины), титан – в синий (сапфир), кобальт – в зеленый, железо и никель – желтый.
В рубине происходит изоморфное замещение Al3+ на Cr3+.
Структурный тип перовскита (тип Е2)
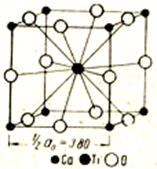
|
| Рисунок 11.12 – Кристаллическая решетка перовксита |
Ему изоморфны BaTiO3, Ca, Zn, PbTiO3.
В элементарной ячейке (кубической) – в вершинах - ионы титана, в серединах ребер - ионы кислорода (рис.11.12), а ионы кальция - внутри ячейки. Решетка не обьемоцентрированная, а примитивная, т.к. внутри и по вершинам располагаются разные атомы. Если выбрать начало координат в одном из ионов титана, тогда координаты ионов: титана [[000]], кальция [[1/2 1/2 1/2]], кислорода [[0 1/2 1/2]], [[1/2, 0 1/2]], [[1/2 ½ 0]].
Ион кальция принадлежит ячейке целиком. Ионы титана находящиеся в вершинах, дают вклад 8×1/8=1, ионы кислорода 12×1/4=3. Стехиометрическое отношение Са :Ti :O=1:1:3, то есть ZCaTiO3=1
Координационные числа и многогранники:
Ti по Ca 8 – куб;
Ti по O 6 –октаэдр;
О по Ті 2 – гантель;
О по Са 4 – квадрат;
Са по О 12– кубооктаэдр.
Ионы Са и О сообща образуют плотнейшую упаковку, т.е. катион Са очень большого размера, примерно такого же, как и кислород, занимает положение шаров плотнейшей упаковки.
Дата добавления: 2015-06-27; просмотров: 10682;
