Качественное обнаружение и количественное определение активности. Единицы активности (МE, катал). Удельная активность. Число оборотов ферментов.
О скорости ферментативной реакции судят или по скорости убыли субстрата, или по скорости образования продукта.
За единицу активности любого фермента (Е) принимается то количество фермента которое в оптимальных условиях катализирует превращение 1 мкмоля субстрата в 1 мин.
Существует другая единица активности:
1 катал - количество фермента, который катализирует превращения 1 моля субстрата в 1 секунду.
1 Е фермента = 16,67 нкатал.
Для выражения активности фермента пользуются определением удельной и молекулярной активности.
Удельная активность - число Е ферментативной активности в расчете на 1 мг белка.
Чем выше очистка фермента, тем выше удельная активность.
Число оборотов фермента (молекулярная активность) - число молекул S,подвергающихся превращению одной молекулой фермента в 1 минуту. (Или число элементарных актов катализа, осуществляемой 1 молекулой фермента за 1 минуту).
Число оборотов широко варьирует, например:
1. Карбоангидраза (катализирует перенос Н2СО3) совершает 36 000 000 оборотов.
2. Каталаза - 4000 оборотов.
3. Фосфоглюкомутаза - 1240 об/мин.
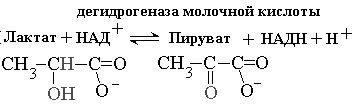
Для качественного обнаружения и количественного определения активности сложных ферментов используют следующие методы: ЛДГ CH3 CH3
лактат -------- ПВК CH-ОН ------- С=О
НАД НАД.Н+Н COOH COOH
НАД.Н интенсивно поглощает свет ( =340 нм). По изменению ПВК можно судить о НАДН.
На одну молекулу лактата образуется одна молекула НАД.Н.
НАД.Н интенсивно флюоресцирует. Интенсивность флюоресценции будет пропорциональна концентрации.
В общем виде под активностью понимают количество фермента или биологического материла, содержащего фермент, которое при определенных условиях катализирует в единицу времени превращение определенного количества реагента, называемого субстратом. Активность - это изменение количества субстрата под влиянием фермента в единицу времени. Под изменением субстрата понимают снижающееся в единицу времени количество субстрата или же увеличивающееся количество продукта. Понятие "активность фермента" по сути дела идентична понятию "скорость ферментативной" реакции. Ферментативная активность выражается в единицах активности. В связи с существованием различных систем единиц исчисления введена интернациональная (стандартная)единица активности. Она носит символ "U" (unit-единица) и определяется как 1 мкмоль субстрата/мин. В системе СИ в качестве единицы ферментативной активности используют "катал" (kat). Катал определяется как 1 моль/сек.
1kat = 1 моль/сек.
Размерность её слишком велика, на практике пользуются меньшими кратными значениями, начиная с нанокатала (нкат). Это одна миллиардная катала или 10-9 кат. В сравнении с международной единицей следующее уравнение
1 U = 16,67 нкат
В практике лабораторий широко пользуются понятием удельная активность. Для этого число cтандартных единиц пересчитывают на какую-либо единицу сравнения. Это может быть мг белка в пробе или объем исследуемой биологической жидкости. Определение активности ферментов широко распространено в любой современной клинической лаборатории.
При исследовании кинетики реакций используется и такое понятие как молекулярная активность. Она показывает, сколько молекул субстрата в секунду превращаются в продукт 1 молекулой фермента и используется для сравнительной характеристики активности нескольких ферментов.
Пример вычисления активности фермента:
| Исходные данные: | Через 10 мин: |
| 25.0 x 10-3 моль л--1 пептида-субстрата, объем реакционной смеси 2.5 мл, 0.50 µг химотрипсина[1] | 18.6 x 10-3 моль л--1 пептида -субстрата, Объем реакционной смеси 2.5 мл, 0.50 µг химотрипсина. |
| Использованный субстрат | = 6.4 x 10-3 моль л-1 за 10 мин |
| Скорость реакции | = 6.4 x 10-4 моль л-1 мин-1 |
| Активность Фермента (скорость x объем) | = 6.4 x 10-4 моль л-1 мин-1 x 2.5 x 10-3 л = = 1.6 x 10-6 моль мин-1 |
| Удельная активность (активность / масса) | = 1.6 x 10-6 моль мин-1 / 0.50 µг = = 3.2 x 10-6 моль µг-1 мин-1 |
| Число оборотов (уд. акт. x молярная масса) | = 3.2 x 10-6 моль µг-1 мин-1 x 25,000 x 106 µг моль-1 = 8.0 x 104 мин-1 =1330 сек-1 |
Если удельная активность, рассчитанная выше, относится к чистому химотрипсину, образец, давший, например, удельную активность 2.0 x 10-7 моль µг-1 мин-1 - 100 % x 2.0 x 10-7 / 3.2 x 10-6 или 6.3 % чистоты. 1.0 µг такого образца на самом деле содержит лишь 0.063 µг химотрипсина и 0.937 µг примесей.

Рис2-4. Молярное поглощение НАД+,НАДН+Н+, ФАД, ФАДН2 при разных длинах волн поглощаемого света
Методы исследования активности определяются механизмом реакции и природой определяемого вещества. Наиболее широко используются:
· Измерение изменения спектральных свойств (измерение поглощения света в видимой или ультрафиолетовой области, измерение флюоресценции) при помощи спектрофотометров, ФЭКов, спектрофлуориметров. Эти методы применяют и для определения количества продуктов или субстратов реакции, и для изменений количества коферментов, участвующих в реакции. Последнее нашло широкое применение в практике клинических биохимических лабораторий. В основе этих методов лежит закон Beer-Lambert: A = e x c x l = log (I0/I) (e, поглощение 1 M раствора вещества при специфической длине волны или молярный коэффициент экстинкции; c, концентрация ; A, поглощение ; l, длина в см кюветы спектрофотометра ; I0, интенсивность падающего света; I, интенсивность прошедшего света). В случае, если молярный коэффициент экстинкции ( исследуемого вещества неизвестен, исследователь определяет экспериментально зависимость между поглощением света исследуемого раствора и концентрацией этого вещества и использует полученную закономерность в форме стандартного (калибровочного) графика.
На рисунке 2-4 показаны спектральные характеристики коферментов НАД и ФАД в окисленной и восстановленной форме. Измерение поглощения при 340 нм используется для количественной оценки активности ферментов, катализирующих окислительно-восстановительные реакции c участием НАД. Вот пример такого расчета для реакции, катализируемой лактатдегидрогеназой В этой реакции молочная кислота окисляется, передавая водороды на НАД+. При этом НАД+ восстанавливается до НАДН +Н+., который в отличие от НАД+ поглощает свет с длиной волны 340 нм. Допустим, за время проведения реакции поглощение при длине волны 340 нм изменялось на 0.31 единицы в минуту. Измерения проводили в кювете шириной 1 см. Коэффициент молярной экстинкции для НАДН при 340 нм e = 6200 л моль-1 см-1 .
| Увеличение [НАДH] = | Увеличение поглощения e . l | 0.31 | =5.0 х10-5 моль/л |
Эту величину можно использовать для оценки скорости реакции.
· Измерение изменений концентрации высвобождаемых или поглощаемых во время реакции H+ или ОН- при помощи pH-стата (устройство, которое автоматически добавляет кислоту или основание, сохраняя постоянство pH в реагирующей смеси)
· Химический анализ с использованием высокоразрешающей жидкостной или газовой хроматографии, или ЯМР или тонкослойной хроматографии. (АТФазы)
· Изотопный анализ (например, с использованием радиоактивного 32P)
Дата добавления: 2015-06-27; просмотров: 2301;
