Кинетика смешанных неконкурентных ингибиторов
Фермент может связываться и с субстратом и с ингибитором с образованием комплексов:

Однако в отличие от конкурентного торможения и субстрат ингибитор способны одновременно связываться с ферментом, образуя тройные комплексы:
 |
Такой комплекс не способен катализировать реакцию.

Обратите внимание, что комплекс EIS может возникать двумя путями, но конечный результат один и тот же - образуется неактивный фермент. Ингибитор может работать одинаково хорошо при низких концентрациях субстрата, когда большая часть молекул фермента находится в форме свободного фермента, и при высоких концентрациях субстрата, когда фермент находится в форме ES комплекса, поскольку ингибитор связывается одинаково хорошо с обоими из них.
Влияние на KmКлассический смешанный неконкурентный ингибитор не оказывает влияния на связывание субстрата, сродство фермента к субстрату и следовательно не влияет на Км.
Смешанный ингибитор позволяет субстрату связываться, но снижает его сродство, так что Км повышается.
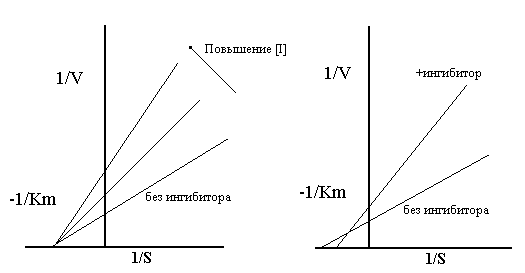
График Лаинуивера-Берка для неконкурентного классического(слева) и смешанного типов ингибиторов
Влияние на VmaxНеконкурентные и классический и смешанный варианты, тормозят активность при высоких концентрациях субстрата, так что Vmax снижается.
Влияние на Vmax/KmНеконкурентные ингибиторы могут работать при низких концентрациях субстрата так, что Vmax/Km снижается.

График Лайнуивера-Берка для типичного классического смешанного неконкурентного ингибитора и для смешанного неконкурентного. На графике для смешанного конкурентного ингибитора две линии по разному пересекают 1/ [S], указывая на увеличение Км, хотя на графике для классического смешанного неконкурентного ингибитора, значения Km идентичны. Однако оба графика показывают увеличение наклона в пересечении на оси 1/V, демонстрируя, что ингибитор является эффективным при высоких и низких концентрациях фермента.
Заключение. Смешанные неконкурентные ингибиторы связываются с центром, который является отдаленным от активного центра. Они тормозят активность фермента, вызывая изменения конформации , препятствующие превращению субстрата в продукт. Субстрат и ингибитор способны к связыванию с ферментом одновременно, образуя тройной комплекс. Это означает, что ингибитор не конкурирует с субстратом при высоких концентрациях субстрата и работает одинаково хорошо и при низких и высоких концентрациях субстрата. Правда способность связываться (сродство) с комплексом ингибитор+фермент у субстрата может снижаться, хотя на практике нет особых различий между так называемым смешанным ингибитором и классическим неконкурентным ингибитором.
Неконкурентные ингибиторы не могут связаться со свободным ферментом.
Понятие неконкурентный ингибитор часто смешивают с понятием смешанный неконкурентный ингибитор! Ингибиторы такого типа встречаются редко, хотя они имеют прямое отношение к изучению мультисубстратных ферментов.
Главная особенность этих ингибиторов - они не способны связываться со свободным ферментом. Они связываются только с фермент-субстратным комплексом. Это объясняется тем, что субстрат сам непосредственно включен в связывание ингибитора или связывание субстрата вызывает изменение конформации в связывающем ингибитор центре, облегчающее связывание ингибитора. Связывание ингибитора вызывает торможение активности фермента и превращение субстрата в продукт. Это может быть следствием прямого взаимодействия, или изменения конформации активного центра.
Дата добавления: 2015-06-27; просмотров: 1109;
