Конкурентные ингибиторы не влияют на Vmax, они понижают Км.
Реакции связывания и субстрата и конкурентного ингибитора протекают быстро и обратимы, так что они существуют в равновесии. Позиции этого равновесия будут зависеть от концентраций реагентов. Учитывая, что фермент участник обеих реакций их равновес  ные состояния взаимосвязаны. Это означает, что при высоких уровнях ингибитора фактически все молекулы фермента будут участвовать в образовании EI комплекса, и фермент будет почти полностью ингибирован. С другой стороны, при высоких концентрациях субстрата почти все молекулы фермента будут связаны в ES комплексе и ингибитор не сможет связаться с ферментом. Высокие концентрации субстрата снимают действие ингибитора. Субстрат и ингибитор конкурируют друг с другом.
ные состояния взаимосвязаны. Это означает, что при высоких уровнях ингибитора фактически все молекулы фермента будут участвовать в образовании EI комплекса, и фермент будет почти полностью ингибирован. С другой стороны, при высоких концентрациях субстрата почти все молекулы фермента будут связаны в ES комплексе и ингибитор не сможет связаться с ферментом. Высокие концентрации субстрата снимают действие ингибитора. Субстрат и ингибитор конкурируют друг с другом.
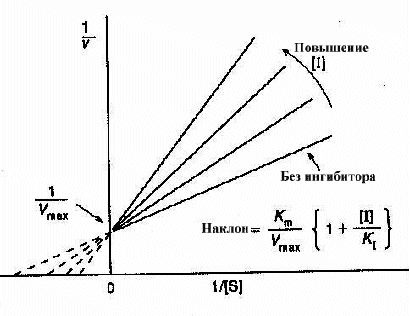
График Лаинуивера-Берка в случае классического конкурентного ингибирования
Эффект на Km Км - индикатор сродства субстрата и фермента. В присутствии конкурентного ингибитора некоторые молекулы фермента будут существовать как свободные ферменты, другие как комплексы ингибитора фермента. Первые будут иметь нормальное сродство, а вторые полностью неспособны к связыванию субстрата. Км измеряет полное сродство фермента в реагирующей смеси, которое будет представлять среднее значение между нормой и нулевым значением этого сродства, и поэтому будет явно меньше нормального значения. Так что конкурентный ингибитор уменьшает сродство субстрата и фермента, или увеличивает Км.
Эффект на VmaxVmax - скорость при высоких концентрациях субстрата. Поскольку в этих условиях, ингибитор вытесняется субстратом, он не тормозит фермент вообще и, следовательно, конкурентные ингибиторы не замедляют реакцию при высоких концентрациях субстрата, и не изменяют Vmax. Это можно хорошо видеть на графике Лайнуивера-Берка. Наклон графика равен Km/Vmax. Увеличение наклона в присутствии ингибитора указывает на снижение скорости реакции при низких уровнях субстрата.
Наиболее часто приводимый пример конкурентного ингибирования - это использование малоновой кислоты для торможение дегидрогеназы янтарной кислоты. Наиболее близким структурным аналогом сукцината является малоновая кислота.
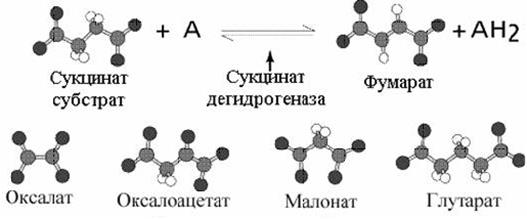
Примеры конкурентных ингибиторов.
Малоновая кислота тормозит активность дегидрогеназы янтарной кислоты, занимая активный центр на ферменте. Учитывая обратимость реакции, избыток янтарной кислоты снимет действие малоновой кислоты.
Дата добавления: 2015-06-27; просмотров: 1283;
