Неконкурентных ингибиторы неактивны при низких концентрациях субстрата.

Для связывания неконкурентного ингибитора, фермент должен сначала связаться с субстратом:

и только затем происходит связывание с ингибитором:
 |
Комбинация ингибитора со свободным ферментом:
невозможна.
Это означает, что неконкурентные ингибиторы неактивны при очень низких концентрациях субстрата, когда почти весь фермент присутствует в свободной форме. При высоких концентрациях субстрата, когда большая часть молекул фермента присутствует в форме комплекса с субстратом, ингибитор эффективен.
Влияние на KmНеконкурентные ингибиторы оказывают довольно неожиданный эффект на Км. Поскольку ингибитор связывается с комплексом субстрата и фермента, он эффективно уменьшает концентрацию этого комплекса, превращая часть его в тройной EIS. По закону действующих масс это способствует смещению равновесия субстрат связывающей реакции вправо и тем самым ингибитор увеличивает количество субстрата, который связывается с ферментом, давая очевидное увеличение сродства фермента к субстрату и уменьшение Км.
Эффект на VmaxПоскольку ингибитор не вытесняется большими количествами субстрата, а наоборот, при больших количествах субстрата быстрее идет образования его комплекса с ферментом, необходимого для проявления действия ингибитора и поэтому уменьшается Vmax.
Влияние на Vmax/KmТак как эти ингибиторы не работают при низких концентрациях субстрата, Vmax/Km не меняется.
Типичный график Лаинуивера - Берка для неконкурентного ингибитора представлен на рис. 2-12.
Вывод. Неконкурентные ингибиторы могут связываться только с комплексом субстрат-фермент, но не со свободным ферментом. В результате они не действуют при очень низких концентрациях субстрата. Они способствуют явному увеличению сродства фермента к субстрату, поскольку большее количество субстрата связывается с ферментом для образования, правда, неактивного тройного комплекса
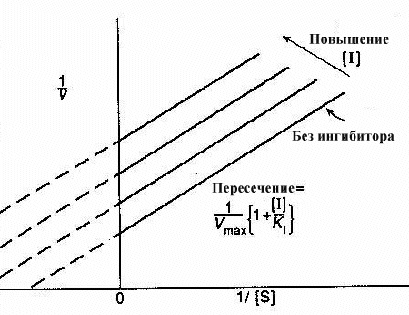
Рис 2-12. График Лаинуивера-Берка для неконкурентных ингибиторов
Дата добавления: 2015-06-27; просмотров: 943;
