Факторы, определяющие активность ферментов [E], [S], [P], Km. Влияние pH, [P], tº, ионной силы на активность ферментов.
У каждого фермента существует свой pH-оптимум.Существенное влияние на активность ферментов оказывает реакция среды. Для проявления их оптимального действия чаще всего существует узкий диапазон измерения pH среды (pH-оптимум). В некоторых случаях сдвиг pH на единицу снижает активность на 80%. Поэтому в экспериментальных условиях работы с ферментом очень важно поддерживать pH на постоянном уровне.
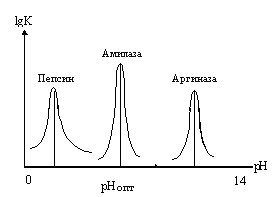 Слева приведены кривые зависимости активности фермента от изменения pH среды. Пепсин желудочного сока, который катализирует гидролиз белков, имеет pH-оптимум при pH=2. При pH=3 он теряет половину активности, а при pH=4 активность пепсина не измеряется. pH-оптимум амилазы, фермента, катализирующего расщепление крахмала, составляет 7,0. И в этом случае изменения pH на единицу приводит к снижению активности на 50%, а - на 2 единицы отмечается полная потеря активности. Относительно редко встречаются случаи, когда pH-оптимум активности ферментов находится в сильно кислой или щелочной среде. Это характерно для таких ферментов как пепсин и аргиназа (катализирует расщепление аргинина). Большинство белков при экстремальных значениях pH неустойчивы. рH-оптимум является важной характеристикой фермента, но ни как не исключительной, присущей только данному ферменту.
Слева приведены кривые зависимости активности фермента от изменения pH среды. Пепсин желудочного сока, который катализирует гидролиз белков, имеет pH-оптимум при pH=2. При pH=3 он теряет половину активности, а при pH=4 активность пепсина не измеряется. pH-оптимум амилазы, фермента, катализирующего расщепление крахмала, составляет 7,0. И в этом случае изменения pH на единицу приводит к снижению активности на 50%, а - на 2 единицы отмечается полная потеря активности. Относительно редко встречаются случаи, когда pH-оптимум активности ферментов находится в сильно кислой или щелочной среде. Это характерно для таких ферментов как пепсин и аргиназа (катализирует расщепление аргинина). Большинство белков при экстремальных значениях pH неустойчивы. рH-оптимум является важной характеристикой фермента, но ни как не исключительной, присущей только данному ферменту.
| Табл 2-2.Значения pH опт. некоторых ферментов | |
| Фермент | pH опт. |
| Липаза (подж.железа) | 8.0 |
| Липаза (желудок) | 4.0 - 5.0 |
| Липаза(касторовое масло) | 4.7 |
| Пепсин | 1.5 - 1.6 |
| Трипсин | 7.8 - 8.7 |
| Уреаза | 7.0 |
| Инвертаза | 4.5 |
| Мальтаза | 6.1 - 6.8 |
| Амилаза (подж.железа) | 6.7 - 7.0 |
| Амилаза (солод) | 4.6 - 5.2 |
| Каталаза | 7.0 |
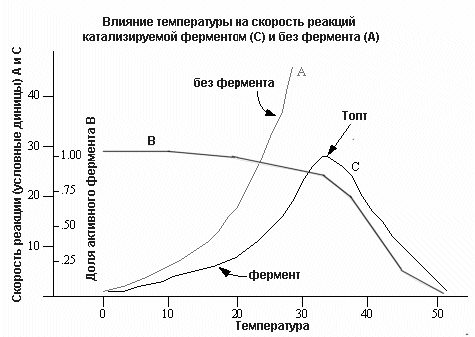
Влияние температуры на активность фермента
Дело в том, что многие ферменты имеют схожие значения pH-оптимумов. Механизм влияния pH среды на активность ферментов заключается в том, что изменение этого показателя приводит к изменению степени ионизации амино- (NH3) и карбосильных (СОО-) групп в молекуле фермента. В результате белковая молекула фермента подвергается конформационным перестройкам, что сказывается на взаимоотношения между ферментом и субстратом.
Дата добавления: 2015-06-27; просмотров: 4077;
