Ферменты характеризуются высокой специфичностью
Специфичность - одно из удивительных свойств ферментов, обусловленное их белковой природой. Уже первые исследователи механизма действия ферментов отмечали это уникальное свойство ферментов, отличающее их от известных в то время катализаторов. Не вызывало сомнений и то что фермент действует не всей своей поверхностью, а свои функции выполняет при помощи отдельных участков этой поверхности. Участок молекулы фермента, обеспечивающий выполнение основных функций фермента получил название активного центра. Э. Фишер, пораженный этим свойством ферментов, предложил для объяснения специфичности взаимодействия фермента и субстрата модель «ключа и замка».
Эта модель предполагала существование такого центра как особой структуры и без связи с субстратом. Жесткие рамки взаимоотношений ключа и замка были дополнены моделью индуцированного взаимодействия, предложенной Д. Кошландом, моделью «рука-перчатка». Эта модель была подтверждена при помощи метода рентгеноструктурного анализа, позволившего построить пространственную модель фермента. Первым ферментом, пространственная структура которого была исследована этим методом, был лизоцим. Этот фермент катализировал расщепление полисахаридов стенки бактерий и некоторых грибов. Он был выделен из яиц, слюны и других биологических жидкостей. Лизоцим состоит из 129 аминокислот. В 1965 году Д.Филлипс расшифровал пространственную структуру лизоцима. Молекула представляла элипсоид вращения с размерами 30х30х45 ангстрем. В лизоциме были выявлены 5 a -спиральных и три b -структурных сегмента. Исследователи сразу обратили внимание на проходящую поперек молекулы глубокую расщелину, в которой помещались 6 моносахаридов субстрата. При этом 4 из 6 моносахаридов были комлементарны форме активного центра и хорошо размещались в активном центре, а для размещения двух моносахаридов потребовалось изменить их конформацию. В активном центре лизоцима были выявлены аминокислотные остатки, обеспечивающие связывание фермента и субстрата и аминокислотные остатки, обеспечивающие проведение реакции. В последующем такие исследования были проведены со многими ферментами, что позволило выявить в активном центре целый ряд функциональных групп или участков:
Способствующие группы – обеспечивают пространственную ориентацию субстратов уже при сближении фермента и субстрата, что позволяет субстрату взаимодействовать с активным центром фермента в наиболее благоприятной конформации.
Якорный или субстрат связывающий участок – обеспечивает наиболее адекватное и прочное связывание субстрата в активном центре фермента.
Химические связи, стабилизирующие пространственную структуру белков, природа применила и для взаимодействия фермента и его субстрата. К этим связям следует отнести прежде всего нековалентные связи и взаимодействия. Это
1. Силы Ван дер Ваальса
2. Электростатическое взаимодействие
3. Водородные связи
4. Гидрофобные взаимодействия
Каталитический участок - формируется группами , обеспечивающими проведение катализа
Вспомогательные группы – группы, повышающие реакционоспособность каталитического участка.

| Якорный участок трипсина представлен длинным узким карманом с отрицательно заряженный Асп в глубине кармана. В этой карман легко проникают аминокислоты, имеющие длинную боковую цепь с положительным зарядом на конце; такими аминокислотами являются Лиз или Ар, которые хорошо связываются и распознаются, а гидролиз происходит на соседней пептидной связи. |
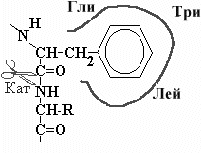
| В гидрофобном кармане, образованном радикалами Гли, Три и Лей химотрипсина располагается боковая цепь с ароматическим кольцом (Фен, Тир или Три).. Пептидная связь образованная СООН группой ароматической аминокислоты устанавливается рядом с каталитическим участком химотрипсина. |
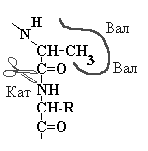
| Фермент эластаза подобен химотрипсину, но в эластазе, часть кармана блокирована парой объемистых валинов. Наиболее комплементарным этому карману может быть участок пептида содержащий Ала или Гли |
Пространственная структура групп формирующих активный центр и является структурной основой специфичности. Специфичность у разных ферментов может проявляться по-разному. Ферменты как белки, построены из L-аминокислот и эта особенность придает ферментам стереохимическую специфичность. Такие ферменты взаимодействуют и катализируют превращения только одного из стерических или оптических изомеров субстрата. Например, одни оксидазы аминокислот избирательно действуют на L-аминокислоты, а другие только на D-аминокислоты. Помимо стереохимической специфичности многие ферменты обладают высокой избирательностью к типу химических групп субстратов. В большинстве случаев избирательность к группам – геометрическая специфичность – даже выше чем стереохимическая специфичность. Правда, лишь небольшая часть ферментов обладает абсолютной специфичностью,т.е. катализирует превращение только одного субстрата. Чаще всего ферменты обладают групповой специфичностью. Это означает, что они действуют на группу субстратов, предъявляя требования к типу группы и типу связи– абсолютная групповая специфичность или только к типу связи – относительная групповая специфичность. Нередко в объяснении типа специфичности используют термин предпочтение. Например, карбоксипептидаза А катализирует гидролиз всех С-концевых пептидных связей за исключением связей образованных Лиз, Арг или Про, если предшествующая аминокислота не Про. Обладая выраженной специфичностью к одному и тому же субстрату, ферменты могут отличаться по типу реакций, которые они катализируют. Например, глюкоза-6-фосфат – субстрат многих ферментов и глюкозо-6-фосфтазы и дегидрогеназы глюкозо-6-фосфата и др. Подобные взаимоотношения складываются у ферментов и с коферментами. Например, существуют дегидрогеназы, которые катализируют реакции окисления только при соединении с коферментом – нуклеотидом НАД+. С НАДФ+, который отличается только одной дополнительной фосфатной группой такие дегидрогеназы не взаимодействуют. И наоборот, есть дегидрогеназы, которые взаимодействуют только с НАДФ+. Некоторые ферменты не проявляют специфичности к типу связи, что нашло применение в лабораторной практике. Многие протеолитические ферменты катализируют гидролиз не только пептидных связей, но и эфирные связи. И если методически количественно трудно оценить скорость реакции гидролиза пептидных связей, то использование синтетических субстратов, представляющих эфиры аминокислот с красящимися веществами, позволяют быстро и просто оценить активность таких ферментов в клинической биохимической лаборатории.
Дата добавления: 2015-06-27; просмотров: 1691;
