Четвертичная структура белков
Под четвертичной структурой понимают структуру белков, состоящих из нескольких полипептидных цепей. Каждая из этих цепей имеет свою завершенную пространственную структуру и называется субъединицей белка с четвертичной структурой. Белок при таком объединении нескольких цепей приобретает новую функцию.


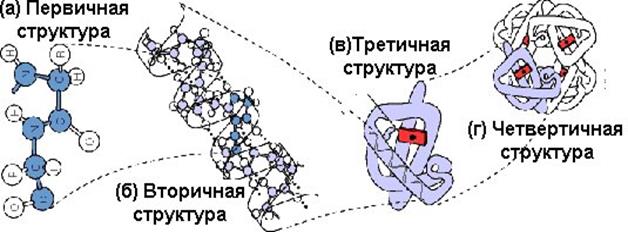
 Уровни структурной организации белковой молекулы
Уровни структурной организации белковой молекулы
 Связи, которые имеются между субъединицами, как правило, нековалентные (силы гидрофобного взаимодействия, ионные, водородные), хотя в ряде белков (например, белки плазмы крови) субъединицы соединены ковалентными дисульфидными мостиками. Создание белков с четвертичной структурной организацией позволило Природе расширить свои возможности в области качественного разнообразия белков при незначительном увеличении количества генетического материала. Например, фермент лактатдегидрогеназа (ЛДГ), состоящий из 4-х субъединиц, формируется из 2-х генетически детерминированных полипептидных цепей H и M. Их разные комбинации (HHHH,HHHM,HHMM,HMMM,MMMM) позволяют существовать в организме 5 ферментам ЛДГ, катализирующих одинаковую реакцию в разных органах и тканях: ЛДГ1, ЛДГ2, ЛДГ3, ЛДГ4 и ЛДГ5. Такие белки с одинаковыми функциями, но отличающимися физико-химическими свойствами получили название изопротеинов (изоферментов).
Связи, которые имеются между субъединицами, как правило, нековалентные (силы гидрофобного взаимодействия, ионные, водородные), хотя в ряде белков (например, белки плазмы крови) субъединицы соединены ковалентными дисульфидными мостиками. Создание белков с четвертичной структурной организацией позволило Природе расширить свои возможности в области качественного разнообразия белков при незначительном увеличении количества генетического материала. Например, фермент лактатдегидрогеназа (ЛДГ), состоящий из 4-х субъединиц, формируется из 2-х генетически детерминированных полипептидных цепей H и M. Их разные комбинации (HHHH,HHHM,HHMM,HMMM,MMMM) позволяют существовать в организме 5 ферментам ЛДГ, катализирующих одинаковую реакцию в разных органах и тканях: ЛДГ1, ЛДГ2, ЛДГ3, ЛДГ4 и ЛДГ5. Такие белки с одинаковыми функциями, но отличающимися физико-химическими свойствами получили название изопротеинов (изоферментов).
Слабое взаимодействие между отдельными частями белкой молекулы дает ей некоторую свободу к изменениям пространственной структуры. Мы уже указывали, что расположение атомов или групп атомов молекулы органического вещества, обусловленное возможностями вращения их вокруг ковалентных связей, получило название конформации. Изменение конформации белковой молекулы лежит в основе ее биологической активности.
Каждая отдельно взятая полипептидная цепь, которая называется протомером, чаще всего не обладает биологической активностью. Эту способность белок приобретает при объединении с другими протомерами. Образовавшуюся при этом молекулу называют мультимером. Мультимерные белки чаще всего построены из чётного числа протомеров. Функционально активная часть мультимера называется субъединицей.
В частности молекула белка глобина состоит из 2a и 2b субъедениц, каждая из которых состоит из двух одинаковых полипептидных цепей соответственно. То есть молекула гемоглобина состоит из четырех полипептидных цепей, каждая из которых окружает группу гема.
При определённых условиях (в присутствии мочевины) или при сдвиге рН молекула гемоглобина обратимо диссоциируют на 2a и 2b полипептидных цепи. После удаления мочевины происходит автоматическая ассоциация исходной молекулы. Это возможно благодаря информации, заложенной в первичной структуре. То есть последовательность аминокислот содержит в себе информацию, которая реализуется на всех уровнях структурной организаци белка. Наиболее изученным мультемерным ферментом является ЛДГ, состоящий из 4-х субъединиц и может существовать в 5-ти формах (изоферменты).
ПЯТЫЙ УРОВЕНЬорганизации представлен в виде ферментных комплексов, которые катализируют цепной и метаболический путь. Эти комплексы называются метаболонами, они чаще связаны с клеточными мембранами.
Стабильность четвертичной структуры обусловлена ковалентными связями между контактными площадками протомеров, которые взаимодействуют друг с другом по принципу комплементарности. Так, например, в гемоглобине каждая субъединица имеет 4 контактные поверхности для связывания с гемом, 3 – для связывания с другими протомерами.
В последние годы была сформулирована теория доменной структуры белка. Домен – это функциональный модуль, рабочая поверхность отдельного белка. То есть белок – это полифункциональный модуль, состоящий из нескольких доменов. Было установлено, что белки выполняющие одну и ту же функцию, но выделенные из разных веществ, имеют сходное строение. Домены друг относительно друга могут смещаться благодаря “ гибкости” белковой молекулы. Смещение происходит под действием температуры, факторов внешней среды, фосфорилирования, метилирования, и это отражается на свойствах и функциях белка.
Уникальная пространственная структура каждой белковой молекулы и ее возможности в определенных пределах изменять эту структуру придают белкам способность выполнять многочисленные специфические функции. Главный принцип, лежащий в основе этой специфичности, это принцип комплементарности или пространственной дополнительности между определенным участком белковой молекулы (активным участком) и молекулой или участком молекулы (лигандом), с которой реагирует этот белок. Активные участки белковых молекул образуются на поверхности в "карманах", "расщелинах". При этом если для функции необходимы гидрофобные радикалы аминокислот, то они, упрятанные от воды в глубине белковой молекулы, становятся доступными благодаря изменению её конформации. В таком случае говорят о кооперативном эффекте, который образно можно представить на модели "рука - перчатка".
Лигандами могут быть самые разные по химической природе вещества: белки, углеводы, липиды, неорганические вещества и т.д. Примерами такого специфического белок-лиганд взаимодействия являются взаимодействие между ферментом и субстратом, антителом и антигеном, рецептором и гормоном и т.д.
Учитывая важность конформационных изменений для выполнения белками их функций, становится понятным, что в регуляции их функциональной активности важная роль отводится факторам, влияющим на конформацию белка. Такими факторами могут быть изменения pH, температуры, которые в равной мере влияют на все белки и могут быть названы неспецифическими факторами регуляции. С другой стороны, это могут быть специфически взаимодействующие с белками вещества и тогда говорят о специфических факторах регуляции. Последние создают неограниченные возможности в специфической регуляции процессами жизнедеятельности.
Дата добавления: 2015-06-27; просмотров: 3460;
