Вторичная структура белков
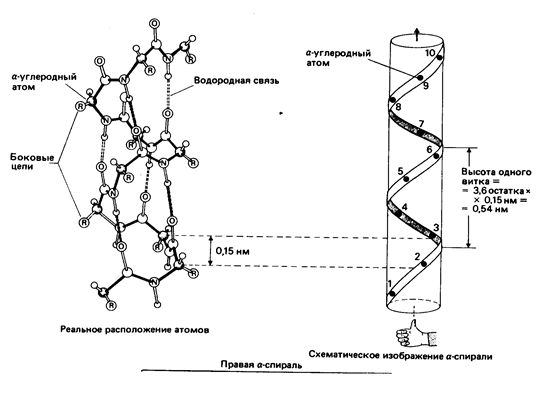
В 1950 г. Лайнус Полинг предложил два вида пространственной структуры белков - альфа-спираль и бета-структуру. Эти понятия сохранились до настоящего времени как виды вторичной структуры белков. Кроме них сейчас различают ещё один, третий тип вторичной структуры - b-поворот. Вторичная структура белка - это локальная конформация полипептидной цепи, обусловленная вращением отдельных участков этой полипептидной цепи вокруг одинарных ковалентных связей.
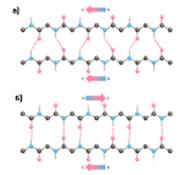
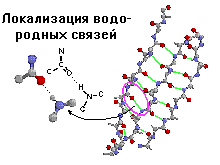
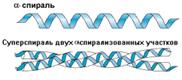
Стабильность спирали поддерживают водородные связи между атомами пептидных группировок аминокислот, расположенных на соседних витках спирали. Все условия, ведущие к формированию спиральных структур, могут успешно реализоваться и при другой форме расположения полипептидной цепи. Эту альтернативную спирали форму назвали -структурой. Она формируется при укладке цепи в форме плоских шпилек. -структура также стабилизирована водородными связями. Из двух или более b-структурных участков полипептидной цепи формируется b-слой. В грубом приближении она плоская и напоминает лист. Однако из-за того, что плоскости пептидных групп в каждом b-структурном участке наклонены поочередно в разные стороны относительно направления этого участка, плоский b-слой приобретает складчатую форму.
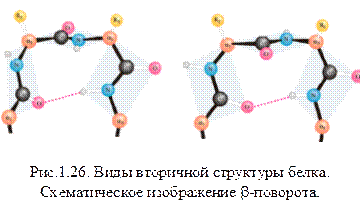
b-поворот или b-изгиб - ещё один тип вторичной структуры, встречающийся во многих глобулярных белках в тех местах, где направление полипептидной цепи меняется на противоположное. Данная структура часто рассматривается как связующее звено между двумя уложенными антипараллельно b-участками в составе b-слоя. Она образуется в полипептидной цепи там, где встречается пролин. Дело в том, что эта аминокислота не может изгибаться, и там где она встречается в полипептидной цепи, a-спираль и b-структура обычно нарушаются. В этом месте образуется своеобразный излом - b-поворот. В b-повороте водородная связь замыкается через три аминокислотных остатка. Там, где встречается b-поворот, полипептидная цепь делает изгиб. b-повороты обычно находятся у поверхности белковой молекулы.
| 
| 
|
Схематическое изображение b-структуры. а) параллельное, б) антипараллельное расположение b-структурных участков полипептидной цепи в b-слое
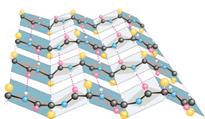
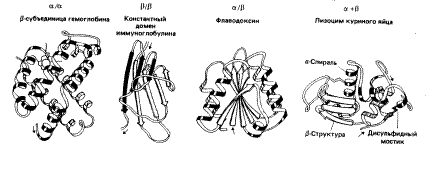
Увеличение числа известных белков привело ученых к необходимости более подробно исследовать пространственную структуру полипептидных цепей. Оказалось, что несколько участков цепи, организованных в пространстве в форме a-спирали или b-структуры, могут объединяться, формируя так называемую надвторичную структуру. В белке может быть несколько организованных таким образом участков. Всех их можно подразделить на четыре класса: a/a, b/b, a/b и a + b, в зависимости от взаимного расположения в цепи a-спиральных и b-структурных участков.
Полипептидная цепь изображается в виде ленты, при этом a-спиральные участки представлены спиралями, b-структурные - стрелками, а нерегулярные - светлыми петлями. Боковые цепи не показаны, хотя во всех белках пространство между атомами основной цепи заполнено атомами боковых цепей. a/a структура состоит в основном из a-спиралей, b-участки в ней практически отсутствуют. a-спирали упакованы таким образом, что неполярные боковые цепи оказываются спрятанными внутрь. В b/b типе имеется несколько b-цепей и нет (или почти нет) a-спиралей. В a/b варианте a- и b-участки чередуются вдоль цепи. Часто b-участки образуют параллельный b-слой, окруженный a-спиралями. В a + b-типе a- и b-участки обычно располагаются в разных сегментах полипептидной цепи.
|
|
Варианты объединения a-спиральных и b-структурных участков (надвторичной структуры) в полипептидной цепи
В крупных белках при сворачивании полипептидной цепи часто образуются две или более пространственно разделенные области, называемые доменами. По своей
структуре каждый домен напоминает отдельный небольшой белок. Обычно в одном домене содержится от 40 до 300 остатков. Доменом называют участок белковой молекулы, образованный несколькими вторичными или надвторичными структурами, имеющий глобулярную форму. В разных белках они могут быть одинаково организованными участками и выполнять одинаковые функции. Домены часто обладают специфическими функциями, такими как связывание небольших молекул.
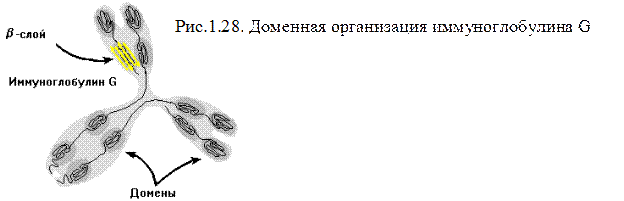
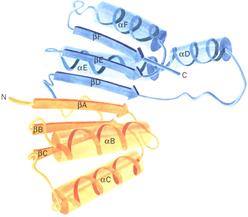
| Обобщенное изображение кофермент-связывающего домена в составе различных дегидрогеназ. Этот домен состоит из двух одинаковых по структуре babab единиц (один - желтого и один - синего цвета). Каждая единица связывает НАД (никотинамидадениндинуклеотид) и образует в месте связывания складку. |
Использование понятия "домен" позволило выделить целые семейства белков, имеющих общего предшественника, что проливает свет на процессы совершенствования живого мира.
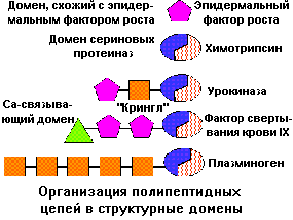
В ряде случаев четко определить функции тех или иных доменов не удается. Между доменами в пределах одной и той же полипептидной цепи устанавливаеются гидрофобные контакты. В этих зонах формируется каталитический центр, а образующие его группы размещены в обоих доменах.
На этом уровне структурной организации белка еще не принимались во внимание возможности взаимодействия радикалов аминокислот между собой и с растворителем (водой), в котором белок должен выполнять свои функции.
Дата добавления: 2015-06-27; просмотров: 4160;
