Стадии процесса образования конденсированного углерода (КУ) и детонационного синтеза ультрадисперсных алмазов (УДА) при взрыве ТГ50/50 в камере с различными средами
(Подробнее PDF Микрокинетика сохранения…)
При рассмотрении процесса взрыв ВВ во взрывной камере установлено четыре стадии (табл.).
1. Детонация ВВ, на которой развивается химическая реакция взрыва до момента выхода за границу ВВ.
2. Разлет продуктов взрыва до границ камеры.
3. Циркуляция ударных волн в полости камеры, приводящая к выравниванию температуры.
4. Стадия охлаждения смеси продуктов взрыва.




1стадия 2 стадия 3 стадия 4 стадия
| Стадии | |||||||
| Детонация заряда | Разлет ПВ до стенок камеры | Циркуляция и перемешивание КУ | Охлаждение смеси | Газификация продуктов взрыва | Сохранение КУ и УДА, | ||
| Заряд | ТГ50/50 | ||||||
| Диаметр камеры d | ~ 2м | ||||||
| Состав ПВ | КУ, УДА | ||||||
| Длительность стадий | ~20 мкс | 200 мкс | 25 мс | ~100 c | |||
| Среда камеры | Вакуум | ||||||
| Т в камере (К) | 3500 – 400 | 400 -3500 | 3500 – 700 | ~100% | Не сохраняются | ||
| Среда камеры | Инертный газ | ||||||
| Т в камере (К) | 3500-700 | 700 -2000 | 2000 – 700 | ~10% | КУ-90%, УДА-10% | ||
| Среда камеры | Водяная оболочка | ||||||
| Т в камере (К) | 3500-1000 | 1000 - 900 | 900 -500 | ~0% | Максимум УДА |
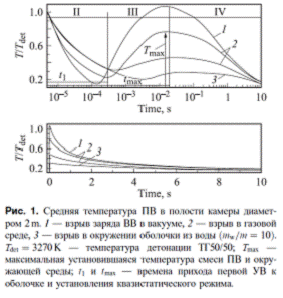
Концентрация КУ и содержание в нем фазы УДА обусловлены температурой среды, установившейся после взрыва перед охлаждением. Максимум УДА будет при температуре среды ~ 550К и соответствует 10% от исходной массы ВВ. При росте температуры среды концентрация УДА уменьшается обратно пропорционально температуре среды и при 2800К исчезает (рис.1).
При условии поддержания в течение ~10-2 секунды достаточно высоких температур (>1550К) развивается газификация КУ (рис.2), происходящая с поглощением энергии.
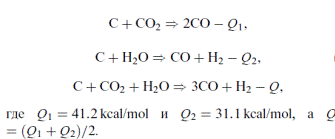
Дополнительная информация
При детонации сильных взрывчатых веществ, например, смеси тринитротолуола и гексогена, давление и температура, возникающие на фронте ударной волны, достигают области термодинамической стабильности алмаза на фазовой диаграмме (рис. 3) углерода (P ≅ 20-30 GPa, T ≅ 3000-4000 K), что приводит образованию алмазных кристаллов непосредственно из углерода взрывчатых веществ в условиях отрицательного кислородного баланса.

Рис.3. Фазовая диаграмма углерода, показывающая Р-Т области для детонационного синтеза алмазов (1) и промышленного статического синтеза алмазов из графита в присутствии металлов-катализаторов (4). (2) и (3) – кривые снижения давление и температуры при детонационном синтезе в разных средах, (2) – в газовой среде, (3) – в водной. ТD - температура Дебая для объемного алмаза.
После детонации температура и давление падают и P-T параметры системы оказываются в области, где алмаз термодинамически нестабилен. Если при этом температура еще достаточно высока для сохранения высокой подвижности атомов углерода (выше температуры Дебая алмаза TD ≅ 1800 K), то обратный переход алмаз-графит будет более вероятен, чем в том случае, когда переход в область термодинамической стабильности графита происходит при T <TD. Чем выше скорость охлаждения, тем меньшее время продукт детонационного синтеза находится в области кинетической нестабильности алмаза и, соответственно, тем меньше вероятность обратного фазового перехода алмаз-графит в процессе синтеза.
Особенностью детонационных наноалмазов является чрезвычайно узкое распределение по размерам кристаллических ядер: как правило, при применяемых режимах синтеза этот размер составляет около 4 нм. Однако из-за тенденции к уменьшению поверхностной энергии наноалмазный порошок, как и другие вещества в ультрадисперсном состоянии, состоят не из отдельных нанометровых частиц, а из их агрегатов размерами ~1мкм. В водной суспензии частицы образуют агрегаты размером от сотен до нескольких тысяч нанометров. Их невозможно дезинтегрировать на первичные 4 нм частицы алмаза традиционной ультразвуковой обработкой суспензии, но с помощью ударных волн удалось разъединить до агрегатов размером 40-60 нм. Полная дезинтеграция наступает только при размоле в шаровых мельницах с шарами из двуокиси циркония микронных размеров.
Такая суспензия обладает необычными оптическими и реологическими свойствами — высоким коэффициентом поглощения в «синей» области спектра и аномально высокой вязкостью.
Получение нанопорошков методом электровзрыва Электровзрыв производится для проводящих сред и представляет собой процесс мгновенных фазовых превращений в результате интенсивного выделения энергии при пропускании импульса тока плотностью 104 –106А/мм2 и длительностью 10-5 – 10-7 с. Заготовкой является проволока диаметром 0,1 –1,0 мм. При электровзрыве происходит нагрев проводника со скоростью более 107К/с до высоких температур Т > 104К и генерация ударных волн, что приводит к формированию нанодисперсных порошков. Особенностью нагрева при прохождении тока является то, что температура внутри проводника больше, чем во внешних слоях. В начале электровзрыва нагрев проводника сопровождается его линейным расширением с относительно небольшой скоростью 1 – 3 м/с. В результате прохождения импульса тока металл перегревается выше температуры плавления, расширение вещества взрываемого проводника происходит со скоростью до 103 м/с и перегретый металл взрывообразно распыляется. Формирующаяся при этом ударная волна имеет в зоне сжатия давление ~103 атм и Т~104 К, соответственно. Быстро расширяющийся пар конденсируется с образованием малых частиц размером от 100 мкм до 50нм в зависимости от параметров взрыва. При этом размер частиц уменьшается с ростом плотности тока и сокращением длительности импульса. Электровзрыв в атмосфере инертных газов позволяет получать порошки исходных металлов и сплавов, а при наличии в среде специальных реагентов: кислорода, азота, воды, углеводородов можно получать тонкодисперсные порошки оксидов, нитридов, карбидов или их смесей. Некоторые нанопорошки, получаемые методом электровзрыва в вакууме и в различных средах представлены в таблице. Частицы металлов имеют сферическую форму, а соединения имеют огранку.
| Металл | Вакуум | Воздух | Азот | Вода | Декан С10Н22 | Парафин~ С18Н38 |
| Al | n-Al | n-Al или Al2O3 | n-AlN | n-Al(OH)3 | n-Al4С3 | Карбиды |
| Fe | n-Fe | n-Fe | n-FeО | n-FeО | Смесь карбидов | |
| Ti | n-Ti | n-Ti | n-TiNy | n-Ti2О3 | n-TiСy | Смесь карбидов |
| W | n-W | n-W | n-WО2 | n-WСy | n-WС | |
| Cu | n-Cu | n-Cu | n-Cu2О |
Дата добавления: 2015-06-22; просмотров: 1294;
