Электродный потенциал
Процессы электрогенеза проще всего воспроизвести на примере физико-химические механизмов возникновения потенциалов в электролитно-коллоидных системах. Начать можно с электродного потенциала, возникающего в системе электрод-электролит.
Представим, что серебряный (Ag) электрод погружен в раствор хлористого серебра (AgCl). На границе металла и раствора возникнет двойной электрический слой, напряженность которого определяется величиной химического потенциала:
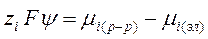 , где:
, где:
mi(р-р)- химический потенциал i-го иона в растворе,
mi(эл),)- химический потенциал i-го иона в электроде
zi – заряд иона,
F – число Фарадея,
Y – потенциал электрода по отношению к раствору.
Если mi(р-р) > mi(эл), то для установления равновесия часть ионов серебра (Ag+) перейдет из раствора в металл, заряжая его положительно.
Если mi(р-р) < mi(эл), то для установления равновесия часть ионов серебра перейдет из металла в раствор, заряжая электрод отрицательно.
При mi(р-р)= mi(эл) заряд электрода будет равен нулю.
Нернст вывел уравнение зависимости величины потенциала электрода от концентрации вещества в растворе и электроде:
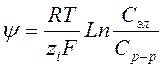
где R – универсальная газовая постоянная, T – абсолютная теипература
При погружении в раствор двух различных металлических электродов металл, у которого электрохимическое равновесие между электродом и раствором устанавливается при более высоких разностях потенциалов между электродом и раствором, будет иметь более отрицательный потенциал. Разность потенциалов возникнет и в том случае, если два электрода из одного и того же металла погрузить в растворы солей этого металла с различной концентрацией (С1 > С2). Разность потенциалов такой концентрационной цепи будет равна:
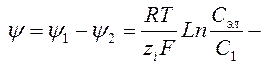
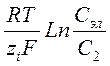
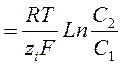
Таким образом, разность потенциалов будет определяться разницей концентраций солей этого металла в растворах, контактирующих с металлом.
Дата добавления: 2015-06-22; просмотров: 1385;
