Пространственная структура белка
Первичная структура белка – последовательность аминокислот (АК). Пептидная связь между аминокислотами (Рис.5) отличается от обычной ковалентной связи перераспределением электронной плотности и, потому, является жёсткой и вокруг неё вращение затруднено. Расстояния в ней соответствуют:
C –N-0,132 нм
N – Ca-0,147 нм
С – Сa-0,153 нм
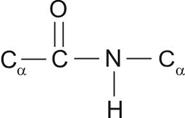
| Рис.5.Пептидная связь между аминокислотами. |
Зато оно возможно вокруг связей С – Сa (угол y) и N – Ca (угол j), за счёт чего и возникают конформации белковых молекул. Число возможных конформаций ограничено, так как согласно расчётам Рамачандрана j и y могут принимать лишь определённые значения. Конформации стабилизируются слабыми взаимодействиями между пептидными группами (вторичная структура) и боковыми остатками АК (третичная структура).
Вторичная структура – упорядоченное расположение полипептидной цепи, стабилизированное водородными связями между пептидными группами.
Чаще всего встречается и наиболее термодинамически выгодна правая a – спираль, постулированная Поллингом и Кори (Рис.6).
1. на один шаг спирали – 3,6 остатка,
2. шаг спирали d = 0,54 нм,
3. трансляция на 1 остаток вдоль спирали Dd = 0,15 нм,
4. радиус спирали r = 0,23 нм,
5. водородные связи параллельны оси спирали и образуются между 1 – 4 аминокислотными остатками,
6. = -57°, y = -47°.
Но возможны и другие виды спиралей. Она обнаруживается в отдельных участках белка, r = 0,19 нм, то есть она более скручена. На 1шаг три АК, водородные связи между 1 –10 АК. Это p – спираль. Она теоретически рассчитана, но пока не обнаружена в белках, r = 0,28 нм, длина шага 4, 4 АМК.
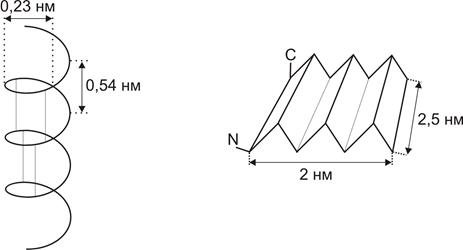
| Рис.6.Вторичная структура белка Слева – α-спираль Справа – β-склад-чатая структура |
Другой тип вторичных структур: b – складчатые структуры.
Водородные связи расположены параллельно оси спирали. Они могут быть параллельными – y = +1130°, j = -119 и антипараллельными – y = +113°, j = -119°, имеют фиксированные значения y и j, включают до 6 белковых цепей, состоящих из 6 остатков, размеры b – складчатого листа 2´2,5 нм. Они могут быть скручены перпендикулярно цепям.
В некоторых случаях выделяют сверхвторичные структуры – суперспирали (например миозин – 2 a – спирали и фибриноген – 3 a – спирали), скрученные относительно друг друга. К третичным структурам их отнести нельзя, так как связи опять же между пептидными группами. Сюда же относятся структуры типа bb или bab.
Третичная структура белка – конформации, стабилизированные слабыми связями между боковыми остатками АК. В основном это Ван – дер – Ваальсовы и электростатические взаимодействия. Переход в растворе от неупорядоченного клубка в наиболее удобную упаковку третичной структуры происходит от 10-6 до 10 у разных белков. Сегменты белка образуют a – спирали и b- структуры, которые затем укладываются в глобулы – домены. Домены относительно автономны, могут самостоятельно раскручиваться и, как правило, являются носителями определённых функций.
Четвертичная структура белка
Наиболее сложные белки, особенно ферменты, имеют ещё более высокую структурную организацию, включающую несколько белковых глобул, объединённых гидрофобными взаимодействиями.
Согласно модели Бреслера – Тилмуда.
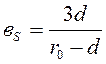 ,
,
где в – отношение числа полярных остатков к неполярным остаткам,
если в»вs – то глобула в растворе будет сферической формы,
если в>вs – то глобула в растворе будет эллипсоидной формы.
если в< вs, то неполярные структуры не могут быть полностью закрыты полярными и тогда и образуются олигомерные структуры, стабилизированы гидрофобными взаимодействиями.
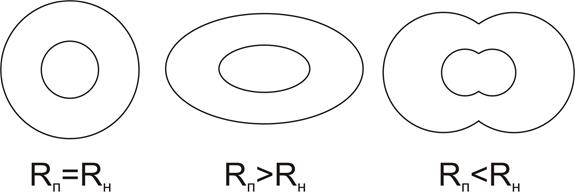
|
| Рис.7.Виды четвертичной структуры белка согласно отношению числа полярных остатков (Rп) к неполярным остаткам (Rн). |
Дата добавления: 2015-06-22; просмотров: 1396;
