Силы внутримолекулярного взаимодействия биомакромолекул
Относительно энергии теплового движения молекул воды при нормальных условиях (~2,5 к Дж/моль) их можно подразделить на сильные, к которым относятся ковалентные (200 – 800 к Дж/моль) и ионные взаимодействия (40 – 400 к Дж/моль), величина энергии которых рассчитывается по закону Кулона:
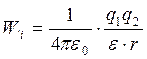 ,
,
где q1 и q2- электрические заряды групп, e и e0- диэлектрические постоянные в среде и ваккууме (e0=8,85 10-23 Кл В-1м-1).
и слабые– все остальные.
К ним относятся:
I. Ван – дер – Ваальсовы силы ~ 4 – 8 кДж/моль.
Эти силы играют роль в образовании конденсированных жидких и твёрдых состояний, во взаимодействиях на поверхности раздела фаз. Они имеют электромагнитную природу и определяются взаимодействием электрических диполей в соседних молекулах
 – это уравнение Ван – дер – Ваальса.
– это уравнение Ван – дер – Ваальса.
где а и в –постоянные притяжения и отталкивания Уравнение Ван – дер – Ваальса описывает отклонения реального газа от идеального.
1. Ориентационные силы (диполь-дипольные).
Когда обе молекулы обладают постоянными дипольными моментами М1 и М2.
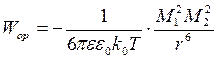 ,
,
где: k0 – постоянная Больцмана, Т –абсолютная температура.
2. Индукционные взаимодействия (диполь-индуцированный диполь).
В том случае, когда первая молекула обладает постоянным дипольным моментом М, а вторая нет, но характеризуется определённой поляризуемостью a, то за счёт создаваемого диполем во второй молекуле 2 электрического поля напряжённостью Е1,, которое равно: 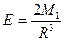 , наводится диполь:
, наводится диполь:

3. Дисперсионные (поляризационные) взаимодействия.
Обе молекулы не обладают постоянными дипольными моментами, но обладают поляризуемостью (a1 и a2) и наведенным потенциалами ионизации I1 и I2.
Взаимодействие обусловлено внешними, наиболее слабо связанными электронами. Природа их носит квантово – механический характер и является результатом появления так называемых «мгновенных диполей» при движении электронов:
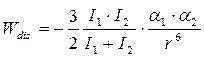
II. Водородные связи (заряд – дипольные взаимодействия)
Это взаимодействия между атомом Н одной молекулы и N, O, S, F, Cl, – другой.
Основной вклад в энергию вносит электростатическое притяжение. Но так же по уравнению Ван – дер – Ваальсова сила и энергия деполяризации двух электронов связи О–Н.
Для воды:
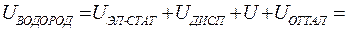
 кДж/моль.
кДж/моль.
В разных точках протон испытывает различные воздействия со стороны электроотрицательных атомов – имеется 2 минимума.
III. Гидрофобные взаимодействия~4 – 8,5 к Дж/моль.
Основано на силах отталкивания воды гидрофобными (неполярными) молекулами. Более корректно их можно определить, основываясь на термодинамике.
Вода представляет собой довольно сложную структуру, ассиметрична и имеет большой дипольный момент (~1,82 дебая (Д).
Тетраэдрическая структура полностью координированной воды.
Молекулы воды ассоциированны с координаторным числом 4, то есть атомы кислорода четырёх молекул образуют тетраэдр, в центре которого атом кислорода пятой молекулы. Структура жилкой воды до конца не ясна. Существуют две группы гипотез:
1. Модель непрерывной структуры воды.
Вода представляет собой непрерывную структуру, связанная водородными связями, и при изменении температуры, давления и других факторов они лишь растягиваются и деформируются. Но по расчётам, тогда при t=25°С r=1,8 г/см3 (а не 1,0).
2. Модели мерцающих кластеров.Франк, Уэн (1957).
Водородные связи формируют короткоживущие (10-10 – 10-11 сек) кластеры, размер которых зависит от температуры. При t=20°С в кластеры входит 29,5% молекул воды.
Вода как полярная молекула может конкурировать с другими полярными молекулами за места образования водородных связей. Но неполярное вещество, попав в водную среду, будет подчиняться другим закономерностям, описанным Каузманом.
Если помните, свободная энергия DG=DH-TDS. При растворении неполярных веществ DG увеличится, но DН почти не изменится, следовательно, DS<0.
Понижение энтропии связано с изменением структуры воды. Вблизи неполярных участков снижается конкуренция за водородные связи, следовательно, повышается вероятность формирования упорядоченных кластеров.
Согласно второму началу термодинамики в неравновесной области система стремится увеличить энтропию. Для этого есть один путь – неполярным молекулам в растворе «установить контакты», вытеснив воду и тем самым разрушить кластеры и снизить упорядоченность системы.
Исходя из этого, была количественно оценена гидрофобность аминокислот в белках. Мерой гидрофобности служит DG при переносе их из 100% этанола в воду:
Try DG=14 к Дж/моль,
Phe DG=10,5 к Дж/моль,
Ala DG=2,1 к Дж/моль,
Ser DG=1,25 к Дж/моль.
Ala и Ser – гидрофильные остатки.
Дата добавления: 2015-06-22; просмотров: 1837;
