Методы исследования биомакромолекул
1. Методы, связанные с оценкой подвижности макромолекул в растворе, что позволяет судить об их форме и молекулярной массе. Например, оценка поступательной и вращательной диффузии макромолекул. Первая используется для молекул преимущественно сферической формы, вторая – эллипсоидной.
Известно, что при движении молекул в растворе возникает сила трения:
F = f u, где
f – коэффициент внутреннего трения (фракционный коэффициент), u -скорость.
Для сферической макромолекулы эта сила будет равна (формула Стокса):
F=6 p h r, где
h – вязкость среды, r – радиус молекулы
Для определения величины f можно использовать коэффициент диффузии:
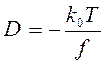 и тогда:
и тогда:
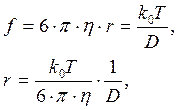
а так как масса молекулы равна:
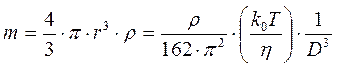 ,
,
то есть масса молекулы обратно пропорциональна коэффициенту диффузии в третьей степени.
Для макромолекул вытянутой формы используется коэффициент вращательной диффузии 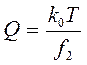 ; для оценки которого используют метод двойного лучепреломления в потоке.
; для оценки которого используют метод двойного лучепреломления в потоке.
Способ определения коэффициента диффузии лежит в основе методов:
Квазиупругое рассеяние света. Этот метод основан на свойстве рассеянного света изменять l.
Изменение l при движении молекул приводит к возникновению эффекта Доплера. Получается информация о динамических свойствах молекул (поступательная и вращательная диффузия, внутримолекулярное время релаксации).
При спонтанной диффузии молекул, обусловленной тепловым движением молекул, спектр рассеянного света подчиняется распределению Лоренца:
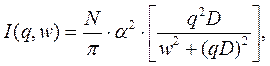 где:
где:
I – интенсивность рассеянного света, w – круговая частота (2 p n) света,
N – число макромолекул в исследуемом объёме,
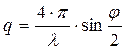 – фактор рассеяние,
– фактор рассеяние,
D – коэффициент поступательной диффузии, j – угол рассеяния света,
a – молекулярная поляризуемость.
Полуширина спектра:
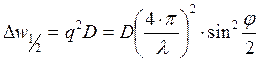 .
.
Измеряя полуширину как функцию sin2j/2, можно получить коэффициент диффузии D.
Сидементация молекул-осаждение веществ в жидкости под действием силы тяжести.
Допустим, в пробирке имеются молекулы с молекулярной массой 105, высота столба жидкости 10-2 м, тогда:
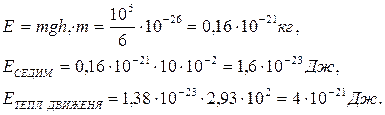
Следовательно, тепловая энергия в 200 раз больше энергии седиментации.
Для регистрации седиментации нужно увеличить уровень энергии на 4 – 5 порядков, что делают с помощью центрифуги. Обычно используют 350 000 g(60 – 70 тыс.об./мин).
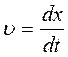 – скорость седиментации.
– скорость седиментации.
Определяя положение шлирен – пик в различные моменты времени, вычисляют скорость седиментации.
На молекулу действуют силы относительно оси вращения ротора:
Fc – сила сопротивления,
Fв – сила выталкивания,
Fц – центробежная сила.
Седиментация заканчивается, когда
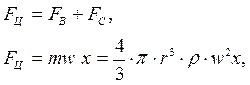
где m – масса, w-объем, r – радиус молекулы, а F  с-1, n – об/мин.
с-1, n – об/мин.
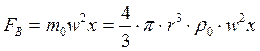 ,
,
где m0 (r0) – масса (плотность) вытолкнутой жидкости
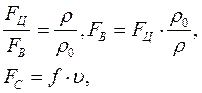
f – коэффициент внутреннего трения, u – скорость седиментации.
Fц – Fв = Fс и выразим Fв через Fц.- Fс:
 или:
или:
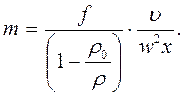
Введем:

где S – коэффициент седиментации (1 сведберг= 10-3с).
Парциальный удельный объём:
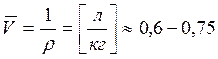
для макромолекул это возрастание объёма растворителя при растворении 1 кг сухого вещества в фиксированном объёме растворителя.
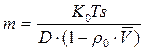
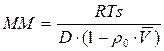 – формула Сведберга.
– формула Сведберга.
Следовательно, нужно заранее определить D и `V и измерить на центрифуге S и получим ММ. Необходимо определить S и D в одинаковых растворителях, при одной температуре.
Электрофорез макромолекул – движение частиц в жидкой фазе под действием электрического поля.
Fэ=q E,
где q – заряд молекулы, Е – напряжённость поля, Fэ – действующая сила.
Fc=f u,
где f – коэффициент трения (для сферы 6phr), Fc – сила сопротивления,
u – скорость движения.
После установления стационарного состояния:
q E = f u при этом скорость движения постоянна (u = const.)
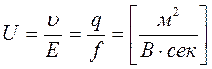 – электрофоретическая подвижность.
– электрофоретическая подвижность.
Для сферы:
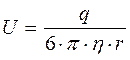
Если исследуют белки (молекулярную массу), то электрофорез проводят в присутствии додецилсульфата натрия (ДСН) в полиакриламидном геле (Вебер, Осборн, 1969). Исследования проводят после обработки 1% раствором ДСН, который является детергентом, обладающим денатурирующим действием, и добавления b – меркаптоэтанола для разрыва дисульфидных связей. ДСН одинаково связывается со всеми белками (1,4 кг ДСН на 1 кг белка). Каждая молекула ДСН несёт один отрицательный заряд и ~ общая плотность зарядов  для разных белков.
для разных белков.
Таким образом, поверхностная «шуба» из молекул ДСН устраняет зарядовые значения между белками. После денатурации белок приобретает форму стержня Æ1,8 нм. Длина ~ молекулярной массе.
В качестве носителя используется полиакриламидный гель в концентрации 5 – 15%.
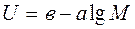 ,
,
где а и в – константы, зависящие от свойств геля.
2. Термодинамические исследования
Дифференциальная сканирующая микрокалориметрия. Измеряется количество теплоты, необходимое для повышения температуры объекта на заданную малую величину – DТ (то есть DН). Если в этот момент происходит «разворачивание» глобулы – DН в камере с белком много больше, чем DН в контрольной камере (буферный раствор) – этот контроль позволяет внести поправку на величину теплоёмкости.
Чувствительность микрокалориметрии – 16 10-6 Дж/моль×град
Кривые представляют в виде температурной зависимости теплоёмкости Ср.
При переходе из нативного в денатурированное состояние максимальная Ср соответствует температуре плавления Тп. Если в белке есть домены с разной термоустойчивостью, кривая имеет два пика.
3. Оптические (спектральные) методы
Рентгеноструктурный анализ.
Этот метод основан на явлении дифракции рентгеновских лучей.
Дифракция – огибание волной препятствия – происходит, когда l сравнима с размером объекта. Поэтому для исследования молекул используются рентгеновские лучи, l ~ размерам атома. Получая дифракционную решётку, можно по картине судить о структуре макромолекул.
Оптическое вращение и круговой дихроизм.
Оба метода основаны на пропускании через образец монохроматического поляризованного света.
Дисперсия оптического вращения (ДОВ) оценивается по углу поворота плоскости поляризации вышедшего света по сравнению с падающим. Основной вклад в неё вносят a – спирали белков и по величине дисперсии можно оценить содержание a – спиралей в белках (зависимость угла поворота a от l).
Круговой дихроизм (КД):
Его величина определяется в разнице поглощения образцом право – и лево – поляризованного света Разница объясняется различными коэффициентами молярной экстинции для право – и лево – поляризованного света и позволяет определить направление, в котором «закручена» спираль – зависит [Q]l от l.
Для каждой хромофорной группы аминокислот, существует точка пика поглощения, преимущественно в УФ области (230 – 310 нм)
Простой абсорбционный спектр, таким образом, может позволить исследовать аминокислотный состав белка.
a – спираль 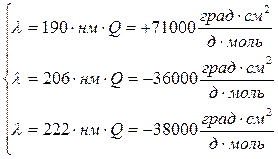
b – спираль 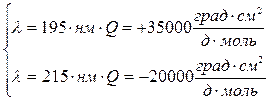
клубок 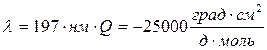
По структуре КД можно определить доли глобулярных и фибриллярных участков и неупорядоченных структур.
Флуоресцентная спектроскопия белков.
а) Собственная флуоресценция белков, имеющих в составе аминокислоты: Tyr, Try, Phe, и по спектру флуоресценции можно судить о положении этих остатков в белке, и взаимодействие его с окружающими группами.
lф чистого Try равна 323 нм, в его вариации в белках от 320 – 342 нм.
б) «Тушение флуоресценции» введёнными хромофорами (то есть миграция энергии с белка на ионы Cs+, J-, акриламид) позволяет оценить доступность хромофорных групп для внешних реагентов.
в) Более удобным в ряде случаев оказывается двухволновой флуоресцентный метод, то есть регистрация одновременно 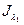 и
и  , что позволяет оценить динамику смещения спектра, так как положение максимальной флуоресценции более чувствительно к конформационным перестройкам
, что позволяет оценить динамику смещения спектра, так как положение максимальной флуоресценции более чувствительно к конформационным перестройкам
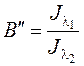 – двухволновой флуоресцентный параметр, он заметно уменьшается при разворачивании глобулы.
– двухволновой флуоресцентный параметр, он заметно уменьшается при разворачивании глобулы.
г) Флуоресцентная спектроскопия с временным (наносекундным) разрешением (флаш – фотолиз).
Флуоресценция возбуждается наносекундными вспышками лазера, и по повороту угла поляризации измеряется степень поворота хромофорной группы за указанное время. Метод позволяет регистрировать быстрые процессы.
Дата добавления: 2015-06-22; просмотров: 1569;
