Боль и болезненность тканей при остеохондрозе
Больной чаще всего обращается к вертеброневрологу не по поводу моторных, координаторных или вегетативных нарушений. Он обычно жалуется на боль. Имеется даже порочная тенденция свести диагностический процесс к оценке «болевого синдрома», а диагностические дефиниции — к альгиям (люмбальгия, брахиальгия, ишиальгия и пр.). Эта слабость не искоренена и в данном руководстве. Боль и впрямь не только биологический сигнал, но и фатально разрушающий энергетический фактор. Попытаемся рас-
1 В этой связи читателю, возможно, небезынтересен такой исторический факт. Два великих человека, деятели культуры К.С.Станиславский и С.ММихоэлс обсуждали метафорический вопрос: что требуется птице, чтобы взлететь. И «решили» — вдохнуть, вобрать в себя воздух...
Ортопедическая неврология. Этиология, патогенез, диагностика, лечение
смотреть этот фактор применительно к проблеме вертебро-неврологии.
Трудно провести резкую черту между болью и болезненностью не только в плане их механизмов, но и в плане кли-нико-описательном. Принято считать: боль — жалоба больного, спонтанно возникающее ощущение, болезненность — то же ощущение, но вызванное искусственным воздействием на больного (надавливанием, постукиванием и пр.). Как, однако, определить, к примеру, болевые ощущения в пояснице у больного остеохондрозом в момент воздействия на больного? Это — боль. По механизму же ее провокации (провоцированное раздражение рецепторов пораженного сегмента в момент наклона туловища) она не отличается от болезненности. В связи со сказанным многие стороны боли и болезненности в практических целях будут рассмотрены ниже под общим углом зрения.
Наиболее частыми при остеохондрозе являются синдромы рефлекторные. Это означает, что в основной массе больных источником боли является не только пораженный позвоночный сегмент с его нервными образованиями (включая чувствительные корешковые волокна), но и те соматические структуры, которые поражаются в связи с рефлекторным воздействием на них. Другими словами, сами пораженные ткани поясницы, таза и ноги — важнейший источник болевых ощущений.
Выше мы неоднократно касались основного источника ирритации в зоне пораженного позвоночного сегмента — рецепторов задней продольной связки, задних отделов фиброзного кольца диска. В последние десятилетия детально изучалась и остеорецепция (Янковский Г.Л., 1982). Одним из самых мощных болевых раздражителей является повышение внутрикостного давления. Его градиент весьма высок — кость информирует центр о различных параметрах давления. При проколе надкостницы возникает острая боль в связи с раздражением телец Фатер-Пачини. Прокол компактного вещества вызывает тактильное ощущение распирающего характера. Костный мозг малочувствителен. Импульсы из кости вместе с раздражителями из кожи и мышц направляются и к общему конечному пути — к мотонейронам спинного мозга, и в краниальном направлении — в продолговатый мозг, зрительный бугор, мозжечок (мшистым и лазящим волокнам), лимбикоретикулярные структуры, подкорковые узлы, и в кору — в темпоральную, фронтальную и центральную области.
Элекростимуляция кости повышает работоспособность мышцы.
Особого внимания заслуживает роль мышц и связанных с ними фиброзных образований в вертебральной и экстра-вертебральных зонах в формировании болевых ощущений. Выше при обсуждении эффекта перерастяжения и надрывов мышцы, действия вибрационных и других раздражений подчеркивалась возможность формирования болезненности мышечных гипертонусов в ответ на эти раздражители. Подчеркивалась роль местных факторов, определявших адресат рефлекторных воздействий: они реализуются чаще в мышцах соответствующего сегмента «запирательного типа», в мышцах, преморбидно готовых к болезненному реагированию. В какой мере данная зона окажется ареной патологических процессов — это, согласно А.А.Ухтомскому (1926), определяется рядом нервных факторов. «Уже в спин-
ном мозгу, — писал он, — импульсы, приуроченные к одному определенному рефлексу, могут питать возбуждение в другом рефлекторном приборе... Это будет получаться всякий раз, пока тот второй, побочный центр будет обладать: 1) достаточно высокой возбудимостью; 2) достаточной способностью удерживать свое возбуждение; 3) суммировать однажды начавшееся возбуждение от приходящих импульсов и 4) продолжать однажды начавшееся возбуждение, вовлекая в свою сферу все новые и новые элементы. Это значит, что судьба реакции решается в наиболее общем случае не в стадии отправления возбуждения, а в станции назначения или в приемнике их»1.
В силу привычного словесного стандарта, а также в связи с утвердившимися в прошлом представлениями о корешковой локализации патологического процесса при «радикулитах» чуть ли не при всех болях в области конечностей подозревалась ее «иррадиация» по корешку в мышечные и другие зоны. Как будто сами болевые ощущения распространяются центробежно! Частично такая схема могла бы быть навеяна данными R.Frykholm'a (1951): механическое раздражение передних корешков вызывает глубинные боли в соответствующем миотоме. Подобные результаты опытов, однако, вовсе не означают, что при этом в эфферентном направлении «иррадиирует» боль. Нет, в этом направлении следуют импульсы, изменяющие состояние мышечных и сегментно-позвоночных структур. Отсюда импульсы следуют в спинной мозг, причем отнюдь не в один лишь задний рог и отнюдь не только в 5 пластину, где конвергируют но-цицептивные сигналы.
Доминанта — принцип межсистемных отношений, активация какой-либо нервной структуры при сопряженном торможении других структур и систем, включая патологические. Патологическая система — это часто невыключен-ный механизм («полом» по Павлову И.П., 1951), часто образовавшийся новый механизм при взаимодействии поврежденных и неповрежденных структур. Он функционирует уже не путем воздействия на организм, а внутри него эндогенно, как очаг генерации внутренних импульсов. Г.И.Маркелов (1939) называл подобные очаги вегетативной патологии на периферии очагами вегетативно-иррита-тивного или реактивного синдрома. Г.И.Крыжановский (1990), описывая подобную генерацию возбуждения и торможения, постулирует положение о генераторе патологически усиленного возбуждения, патологической детерминанты. Нейроны такой системы взаимно активируют друг друга, возникает автономная активность системы. Доминанта — принцип межсистемных отношений, детерминанта — принцип взаимоотношений частей одной системы, принцип формирования синдромов. Это имеет отношение и к болевым синдромам. Мышечные афференты, в отличие от кожных афферентных терминален, посылают импульсы не только в задний рог, но и в зону на протяжении всего спинального сегмента, всех его пластин Рекседа, больше всего в интермедиальной области. По данным P.Wall (1967), П.Г.Костюка и соавт. (1968), импульсация от высокопороговых мышечных афферентов конвергирует на нейронах 5 слоя Рекседа. Нейроны того же слоя возбуждаются от брадикинина. В результате указанной конвергенции возможен как возбуждающий, так и тормозной эффект.
1 Ухтомский А.А. Физиология нервной системы. — М., 1952. — Т. 3, с. 273.
Глава XI. Патогенез
Еще со времен H.Head (1893), Л.Г.Членова (1932), М.И.Аствацатурова (1933) различают филогенетически древнюю, мало дифференцирующую раздражитель прото-патическую чувствительность, главным образом болевую, и филогенетически новую, уточняющую раздражитель, эпикритическую, главным образом глубокую чувствительность. Нервные структуры первой — более тонкие волокна периферических нервов и спино-таламического пути, структура второй — толстые волокна периферических нервов и задних канатиков. Структура и функции уровней эпи-критической чувствительности устойчивы, в условиях патологии выключаются последними. Лишаясь тормозящего влияния эпикритической чувствительности, каузальгопо-добная протопатическая боль проявляется в гротескной форме, как бы берет верх. Уже в коже воспринимаются, с одной стороны, болевые, холодовые и термические раздражители. Это рецептивные поля до 2-3-х кв. мм свободных («голых») окончаний периферического немиелинизи-рованного С-неврона. С другой стороны, неболевые механические и тепловые раздражители воспринимаются в коже в зонах не более 1 кв. мм окончаниями немиелинизирован-ных периферических невронов. Болевые и неболевые аффе-ренты, направляющиеся в глубину заднего рога спинного мозга к V слою Рекседа, уже в самой периферии дают ответвления, где «крадущие клетки» (steal cells) способны затормозить болевой эффект. Кроме того, часть С-волокон связана с симпатическими эфферентами. В момент своего появления острые боли сопровождаются резкими сдвигами со стороны симпатоадреналовой гипоталамо-гипофизарно-надпочечниковой и других эндокринных комплексов, повышается свертываемость крови, усиливается катаболизм (Кеннон У., 1927; Сепп Е.К., 1949; Селье Г., 1960). С тем вместе увеличивается потребление кислорода и распад гликогена в мышцах, происходит изменение ферментативных процессов в них.
В 60-е годы в связи с успехами микроэлектродной техники удалось уточнить взаимоотношения различных видов чувствительности и соответствующих конкретных нервно-клеточных связей.
Поступающие в задний рог спинного мозга афферентные импульсы распределяются по различным пластинам Рекседа (рис. 11.2). Пластина I самая тонкая, обхватывает вершину заднего рога, содержит малые, средние и крупные клетки (от 5-7 до 25-30 мкм). Пластина II занимает больший объем, состоит из одних малых клеток (5-7 мкм). Пластины III и IV составляют основную часть заднего рога. Пластина Vбедна клетками, в ней преобладают нервные волокна, расположенные особенно плотно в латеральных отделах. Пластина VI лежит в основании заднего рога, особенно выражена в шейном и поясничном утолщениях, размеры клеток — от 8 до 15 мкм. Пластины II и III, воспринимая импульсы из кожи, осуществляют пресинаптический воротный контроль (MelzackR., Wall P., 1963) по отношению к импульсам более глубоко расположенных слоев. С помощью микрозондов установлено, что количество и интенсивность ответных импульсов падает от I до III пластин, а затем возрастает от IV до VI пластин.
Моносинаптические контакты с периферическими эфферентами имеют только нейроны I—III слоев. Последующие слои получают импульсацию уже после данного переключения и осуществляют двигательные функции.
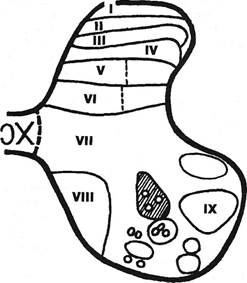
Рис. 11.2. Пластины Рекседа: кружки — клетки Реншоу, заштрихованное — тормозные нейроны системы 1-а.
В I-rV слоях имеются клетки двух функциональных типов. Первые, активирующие, проводят импульсы с каскадным (многократным) усилением — клетки широкого динамического ряда. Вторые, так называемые островковые клетки, оказывают на них пресинаптическое торможение. Островковые клетки получают проприоцептивные коллатерали для воротного контроля.
Дальнейший центростремительный путь болевых ощущений пролегает не только в относительно диффузной экс-тралемнисковой системе (главным образом спино-талами-ческий путь), но, как выше установлено, и в лемнисковой. Диффузный покрышковый путь отдает коллатерали к околоводопроводному серому веществу, интраламинарным ядрам таламуса и другим структурам лимбико-ретикулярной системы.
Со времени J.Langley (1923) считалось, что вегетативная нервная система обладает лишь эффекторным аппаратом, а ее участие в афферентной деятельности Л.О.Орбели (1936) рассматривал как адаптивную: симпатические окончания «настраивают» определенным образом соматические чувствительные волокна. Между тем еще А.С.Догель (1897) описывал симпатические афферентные аппараты — клетки II типа, описывались и проводники (Михайлов С.Е., 1911; Пинес Л.Я., 1941; Микеладзе А.Л., Колосов Н.Г., 1972). А.И.Булыгин (1964), А.А.Милохин (1967) указывают на наличие трех механизмов центростремительных связей внутренних органов: симпатические афферентные пути, симпатические афферентные аппараты (включая клетки II типа Догеля) и комбинированные (афференты вегетативные переключаются на афференты церебральные).
По современной классификации выделяют три группы афферентных миелинизированных мышечных нервных волокон (Lloyd D., Chang H., 1948): I — толстые с первичными окончаниями в веретенах и сухожильных рецепторах Гольд-жи; II — с вторичными окончаниями в веретенах; III — тонкие, со свободными нервными окончаниями, включая ре-
Ортопедическая неврология. Этиология, патогенез, диагностика, лечение
цепторы боли, которые имеются и в кровеносных сосудах. Кроме того, в мышцах есть и немиелинизированные волокна типа С. Поданным M.J.Stacey (1969), ветвистые нервные окончания без капсул имеются в сухожилиях, фасциях, апоневрозах, мышцах. Известно, что наиболее четкие болевые, а также дискретные температурные ощущения проводятся миелинизированными волокнами группы А, а диффузная жгучая боль, тактильные, температурные ощущения и ощущения давления — немиелинизированными волокнами группы С (Mullan S., 1968). Участие последних в формировании боли понимается следующим образом. Толстые мякот-ные волокна задних корешков активируют не только вставочные нейроны передачи информации, но и клетки жела-тинозной субстанции. Последние вызывают пресинаптичес-кую деполяризацию терминалей тех же первичных афферен-тов, ограничивая их приток. Таким образом, желатинозная субстанция подавляет поток афферентных импульсов. Эту-то функцию клеток и угнетают тонкие заднекорешковые С-волокна, тем самым увеличивая выше критического (болевого) уровня афферентный поток к центральным нейронам (Melzack-R.; Wall P., 1965; Бальдман А.В., 1972).
Пока клиницисты, обогащенные рабочей концепцией Геда-Мелзака, все же не получили пока от морфологов и физиологов точного ответа на вопрос о наличии в мышечной ткани болевых (свободных) рецепторов. Похоже на то, что они имеются в стенках сосудов мышц, а также в эндо-, пери- и эпимизии (см. ниже). Что же касается воротного контроля, напомним, что в его тормозном механизме участвуют не только заднероговые сегментарные зоны. Описанный в нашей клинике спинально-заднеканатиково-стволо-вой полисинаптический рефлекс сопровождается последующим торможением биоэлектрической активности (Попе-лянский Я.Ю. с соавт., 1983). При дефиците сложного тормозного механизма соответствующие мозговые аппараты, приходя в состояние активности, и воспринимают раздражение как болевое, притом как локальное, или как возникающее в разных частях данного склеротома.
Известно, что жесткий неоспиноталамический путь заканчивается в вентролатеральном ядре таламуса. Палеоспи-но-таламический путь (состоит из коротких волокон, связывающих спинальную и стволовую ретикулярную формацию) заканчивается в медиобазальном ядре. Волокна третьего неврона чувствительности идут в составе заднего бедра внутренней капсулы к задней центральной извилине и к верхней теменной дольке, неоспиноталамический путь от рецепторов и до задней центральной извилины со времен Геда считают ответственным за острую, хорошо локализованную боль. Палеоспиноталамический путь от рецепторов до верхней теменной дольки считают ответственным за тупую слабо локализованную хроническую боль. Задне-цент-ральная соматосензорная область связана с тонким дискриминационным анализом соматической чувствительности и участвует в восприятии боли. Верхнетеменная область отвечает за первичный ситуационный анализ и регуляцию двигательного ответа на боль (Решетняк В.К., 1985).
Электроэнцефалографические (ЭЭГ) картины больных позвоночным остеохондрозом, как и при других соматических очагах, неспецифичны. Выявляют диффузные изменения: снижение регулярности и амплитуды а-ритма, усиление медленных колебаний. Эти сдвиги уменьшаются при
слабых и увеличиваются при сильных раздражениях эксте-ро- и проприоцепторов (Андреева В.М. с соавт., 1967; Полес-ная А.П. с соавт., 1977). При наличии очага на периферии, особенно левостороннего, наблюдают преимущественные сдвиги в контралатеральном полушарии (Comas A. et ai, 1978; Романенко И.В., 1988; Барвинченко А.А., 1994), отмечают их в соматосенсорной зоне при максимальной стимуляции нерва на уровне очага. Импульсы из периферии вовлекают в интегративную деятельность двигательные и чувствительные нейроны, включая волокна задних канатиков спинного мозга и медиальной петли. При этом, как подчеркивал П.К.Анохин (1962), ни частота афферентной импуль-сации, ни десинхронизация корковых потенциалов не являются показателями боли. Она обусловлена соотношениями процессов на уровне подкорковых аппаратов, т.е. на том уровне, на котором происходит особенно радикальная расшифровка («декодирование») афферентных импульсаций, поступающих с периферии. По своему характеру ЭЭГ нарушения, особенно в правом полушарии, указывают на психовегетативные, психофизиологические нарушения, которые обусловлены влиянием периферического очага на меж-полушарные взаимоотношения. Поданным И.В. Романенко и В.Л.Голубева (1995), левосторонние болевые синдромы сопровождаются более выраженными психовегетативными проявлениями и большими ЭЭГ сдвигами в контралатеральном полушарии. Впрочем, трактовки этих данных спорны, во-первых, потому, что они, видимо, расширяют круг психовегетативных расстройств при вертеброгенных заболеваниях (73%!). Во-вторых же, авторы не учитывают данные Б.В.Огнева (1948) об анатомической асимметрии (висцеро-сосудистых, а не церебральных) симпатических аппаратов — просто поле периферической симпатической импульсаций слева мощнее. В.В.Скупченко (1991) рассматривает психовегетативные и моторные отношения при остеохондрозе как комплексные.
Кроме жестких связей спиноталамо-кортикального пути болевой чувствительности следует учесть многонейронные связи путей, обеспечивающих вегетативно окрашенные болевые ощущения. R.Hassler (1971) такую роль объясняет вегетативными раздражениями, воздействующими по следующему маршруту: желатинозная субстанция заднего рога — продолговатый мозг — гипоталамус — вентральные ядра промежуточного мозга — гиппокамп. Авюр подчеркивает представительство чувственной жизни, эмоций в гипоталамусе и лимбической системе. Нисходящий надсегментарно-нервный и гуморальный путь контроля боли следует из коры, шва, черной субстанции, хвостатого ядра, гипоталамуса, центрального серого вещества, голубого пятна. Этот модифицированный контроль осуществляется на уровне задних рогов.
Эмоционально-аффективная компонента боли также определяется ncuxo-физиологическими факторами (Староби-нец М.Х., Волкова Л.Д., 1980). Сюда относятся постоянный для каждого человека болевой порог первичной острой эпи-критической боли и вариабельный порог хронической тупой вторичной боли. Второй, как и верхний болевой порог во многом связан с психическим состоянием человека (Merskey N., 1973). В этой связи представляет интерес и мнение авторов, подчеркивающих роль указанных церебральных структур в патогенезе болей при остеохондрозе (Лещен-
Общепринятая классификация: миелинизированные толстые — А, миелинизированные тонкие — В, немиелинизированные — С.
Глава XI. Патогенез
ко Г.Д., 1965; Миненков В.А., 1978). Это в основном взгляды, отвергающие однозначную зависимость болей от раздражения обычных свободных болевых рецепторов. Г.А.Иваничев (1990) подчеркивает роль дисфункции полисинаптической системы (в первую очередь дефицита проприоцепции в области мышечного локального гипертонуса) в формировании сенсорных и психоэмоциональных переживаний больного. При объяснении широких зон болевых ощущений указывают обычно на диффузные сетеобразные связи симпатических структур. D.P.C.Lloyd еще в 1941 г. высказал предположение, что в промежуточном ядре заднего рога оканчиваются как афферентные, так и эфферентные волокна, а А.Л.Микеладзе (1965) установил, что афферентные волокна, как соматические, так и висцеральные, отдают кол-латерали промежуточному ядру и нейронам заднего рога. Часть афферентных волокон вступает и через передние корешки, часть располагается в зубовидных связках. Единичные симпатические клетки встречаются и в белом веществе, в радиальных волокнах соединительной ткани, отходящей от боковых рогов. Наличие связей через заднюю спайку и множество коллатералей обеспечивает широкие диффузные связи симпатических элементов. Впрочем, В.А.Берсенев (1977) объясняет дистантные (реперкуссивные) болевые проявления не симпатическими, а анимальными контактами спинальных ганглиев. Согласно экспериментальным данным этого автора, каждый спинальный ганглий обеспечен рецепторами дендритов не только собственных нейронов (Догель А.С., 1897), но и дендритов других спинальных ганглиев. Волокна задних корешков, как оказалось, проходят вначале в задних столбах по соседству с серым веществом, постепенно, на более низких уровнях сдвигаясь кнутри в промежуточной зоне Бехтерева между задним столбом (за-пятовидный пучок Шульце). Нисходящие волокна могут опускаться на 6-7 и более сегментов, где через задние корешки проникают в отдельные спинальные ганглии и образуют в них рецепторы и пресинаптические терминали. Аксоны через задний корешок могут проникать и в краниальном направлении в спинальные ганглии, вступая в синапти-ческий контакт с чувствительными нейронами. Полиси-наптические цепи с их богатыми интрасегментарными связями объясняют и широкие территории, в частности нижний квадрант тела, нередко оказывающиеся полем болевых ощущений. Последние возникают в условиях изменения состояния центральных звеньев указанной цепи (см. патогенез сосудистых расстройств). Говоря о такого рода вегетативно-ирритативных синдромах, Г.И.Маркелов писал: «Этот сложный реактивный синдром вовсе не является банальным невритом. Центр тяжести лежит здесь не в очаге на периферии, а в том вторичном процессе, который в связи с ним развертывается во всей нервной системе. Очаг на периферии лишь в состоянии стойко возбудить всю цепь нервных аппаратов, вплоть до высших центров. В конечном итоге получается замкнутый круг влияний...»1. Эта цепная окружность использует филогенетически древние гуморальные вещества передачи, о которых речь будет ниже.
Что же касается возможного корешкового генеза мышечных болей, то в пользу подобного предположения мог бы говорить факт исчезновения этих болей после удаления грыжи, сдавливавшей корешок. Этой точки зрения придерживались многие хирурги (Frykholm В. et al., 1953;
Fernstrom U., 1960; Осна A.M., I960; Armstrong J., 1965 и др.). Достоверной модели хронической боли при повреждении нерва нет (Loeser J.D., 1985). Известно, что неврома генерирует импульсы и чувствительна к механическим и химическим влияниям. Такова же чувствительность и корешка: даже при легкой демиелинизации его смещение или рефлекторное раздражение вызывает высокочастотные разряды. Однако не у всех больных с грыжей диска возникают корешковые боли. Для их возникновения требуются дополнительные факторы, включая преморбидную готовность воротного контроля в области задних рогов и надсегментарных структур.
Между тем хирургическое удаление диска — это не только декомпрессия корешка, но и изменение рецепторной ситуации в фиброзном кольце и во всем позвоночном сегменте. И некоторые невропатологи склонны были рассматривать боли в конечностях и в пояснице как корешковые (за счет задних ветвей спинномозговых нервов). Д.К.Богоро-динский и соавт. (1975), равно как и R.Maigne (1975, 1981), допускали эту возможность на том основании, что у больных поясничным остеохондрозом иногда выявляется зона гиперальгезии на пояснице, т.е. в зоне, иннервируемой задними ветвями пояснично-крестцовых корешков. С этим, однако, не согласуется сам факт существования люмбаль-гии без болей в ноге при компрессии корешка грыжей диска: если он сдавлен в зоне грыжи, проводимая им боль должна ощущаться и в ноге, откуда корешок несет импульсы. Изолированное же поражение задних ветвей могло бы происходить лишь дистальнее межпозвонкового ганглия, расположенного в межпозвонковом отверстии. Иными словами, изолированная корешковая боль в пояснице почти немыслима за счет грыжи диска. Что же касается гиперальгезии, то она, как уже подчеркивалось, нередко встречается в зонах нейроостеофиброза — корешковая патология тут ни при чем. Не удивительно, что хирургами, удалявшими межпозвонковые диски, представлены многие факты некорешковой локализации не только болей (Fernstrom U., I960; Cyriax J., 1961; Асе Я. К., 1965 и др.), но и зон гипер- и гипо-естезии (Davis С. et al, 1952; Cloward R., 1960; Albert H., 1964 и др.). Ф.Ф.Огиенко (1971) вслед за M.Gukelberger et al. (1958) признает симпатогенный характер боли даже при ра-дикулярных расстройствах чувствительности (легкая степень гипоестезии и разнообразная локализация зон — это нечто вроде зон Геда). О сдвиге возбудимости вегетативных аппаратов с изменениями кожной чувствительности при остеохондрозе говорят соответствующие исследования кож-но-гальванического рефлекса (Мамичев Р.В., 1955; Бугаен-ко П.А., 1959; Агте B.C., 1961), ультрафиолетовой эритемы (Шефер Д.Г., 1959; Голосова Л.О., 1969 и др.), оксигемомет-рических показателей (Ласков В.И., Чертков Н.Н., 1963), пробы на гидрофильность кожи (Бадевич И.А., 1969 и др.), на содержание микроэлементов крови (Ярош А.А., Ищен-ко М.М., 1962; Куликова Е.Т., 1965). Нет, объяснение расстройств кожной чувствительности и болевых проявлений в мышечных зонах при остеохондрозе за счет одной лишь корешковой патологии не может считаться обоснованным. Остается допустить, что источник, генерирующий мышечную боль, находится в самой мышце. Впрочем, в литературе имеются и более определенные высказывания. Еще W.Gowers (1904), обладая данными о веретенах как единст-
1 Маркелов Г.И. Заболевания вегетативной нервной системы. — М, 1948. — С. 586.
Ортопедическая неврология. Этиология, патогенез, диагностика, лечение
венных рецепторах мышц, заключил, что они, как и рецепторы полостных органов, в условиях перераздражения могут стать источником болевых ощущений. В.А.Ткачук (1968) изучал рецепторный аппарат фасций и находил неинкапсу-лированные болевые рецепторы во всех соединительнотканных элементах мышц. Л.В.Калюжный (1984) сообщает, что ноцицепторы мышц с афферентами А-волокон расположены на поверхности мышц и в местах перехода в сухожилие. Они активируются при давлении и быстро адаптируются. Подобные афференты суставов возбуждаются при чрезмерном сгибании и выкручивании. Подчеркивают значение мышечного спазма как источника болевых ощущений (Marinacci A., Lindheimer J., 1961; Finneson В., 1962; De Vries НА., 1966; Wyke В., 1970; Попелянский Я.Ю., 1994 и др.) и болезненности мышц, которая отмечается при крампи (Oppenheim Я., 1896; Ferre О., 1900; Tillman, 1909; Wilder J., 1935; Китов Д., ИлчевскиС, 1965; Веселовский В.П., 1972 и др.) и даже при некоторых формах миотонии. W.Eichler и P.Hoffmann (1935) указывали на болевые ощущения, появляющиеся при электрическом раздражении мышц: они возникают от раздражения рецепторов сокращающейся мышцы, а не от раздражения электрическим током. H.Bayer (1950) объясняет «ревматические» мышечные боли у лиц с гипертонусами Мюллера: а) перевозбуждением рецепторов и, в особенности, б) раздражением вегетативных аппаратов при резком местном напряжении мышцы в условиях собственного рефлекса. В свою очередь сопутствующая гипертонусу анемизация данного участка мышцы повышает чувствительность проприоцепторов (Matthews В., 1933). Другими словами, анемизация мышцы должна бы способствовать подавлению протопатической активности, а не ее высвобождению. Между тем прекращение доступа кислорода крови к тканям вызывает жгучую боль (Мил-нер П., 1973), а его избыток повышает порог боли (Declava N. et ah, 1978). На химические (как и термические) раздражители отвечают ноцицепторы мышц с афферентами С-воло-кон. На них действуют брадикинин, гистамин, серотонин, простагландины, ацетилхолин, различные альгогенные «воспалительные пептиды», субстанция Р, появляющиеся и при повреждениях (Lewis К, 1942;ХаютинВ.М., 1965; Гра-щенков Н.И., 1967; Kellermeyer Е, 1968; Кассиль Т.Н., 1970; Mense S., 1977; Zimmermann U., 1981; Калюжный Л.В., 1984; Lynn В., 1989). Различные комбинации этих субстанций позволяют синтезировать разную картину боли в зависимости от травмирующего агента. В соответствии с химизмом передачи тонкие С-афферентные волокна подразделяются на а) непептидергические, энзимергические и б) пептидер-гические волокна. Первые содержат кислую фосфатазу, вторые же, т.е. пептидергические, содержат субстанцию Р, со-матостатин и вазоактивный интестинальный пептид. Субстанция Р (СР) поэтому участвует не только в болевой передаче, но и в вазодилатации. Афферентные волокна в коже и внутренних органах широко ассоциируют с кровеносными сосудами (связь медиируется гистамином), волосяными фолликулами, потовыми железами. Соматостатинсодержа-щие С-афференты подавляют продукцию СР и оказывают веноспастические влияния (Sicuteri F. et al, 1985).
Известно, что накопление молочной кислоты в мышце связано с чувством утомления. При раздражении афферентных нервов возникает местный ацидоз, увеличивается количество (3-оксимасляной кислоты. В местах повреждения
тканей, наряду с увеличением кислотных валентностей, с повышением концентрации водородных ионов, усиливается переход кальция в ионизированное состояние с вымыванием его из костей (Геблер К., 1935). Поэтому раздражение рецепторов связок и других фиброзных тканей в местах прикрепления к костным выступам способствует остеопо-розу через воздействие на сосуды и изменение обмена, через возникающий ацидоз (Новожилов Д.А., 1958; Hackett D., Huang Т., 1961). Наклонность к гиперкальциемии у больных остеохондрозом позвоночника обнаружили А.Д.Динабург и А.А.Модель (1953), М.И.Островский (1954), Д.С.Губер-Гриц (1960). Т.к. кальциемия выше при шейном, чем при поясничном остеохондрозе, М.К.Бротман (1966) считал, что влияние афферентных импульсов из дистрофически измененных дисков осуществляется и через паращитовидную железу. Мы полагаем, что следует учитывать импульсацию не только из дисков, но и из зон нейроостеофиброза на периферии. С другой стороны, то же раздражение, благодаря указанному остеопорозу, усугубляет недостаточность связочного аппарата в местах прикрепления к костям (Подруш-няк ЕЛ., 1972).
Боль в мышце возникает при условии лишь резкого раздражения рецепторов. Плавное сокращение не сопровождается болью, т.к. отсутствует достаточное раздражение, необходимое для собственного рефлекса мышцы. В норме, согласно исследованиям P.Hoffman и J.Keller (1928), для возникновения собственного рефлекса требуемая скорость изменения длины мышцы тем меньше, чем больше ее исходное напряжение. При локальном мышечном «гипертонусе» уже незначительная скорость движения мышцы вызывает сильный (типа тетануса) собственный рефлекс и боль.
Интенсивность и тягостность болевых ощущений обусловлена малой временной дисперсией импульсов афферентного потока от рецепторов, расположенных близко к спинному мозгу и, в частности, к позвоночнику (Хаю-тин В.М., 1980). Итак, сложные и, признаемся, запутанные современные концепции боли вынуждают клинициста отталкиваться пока от того, что сегодня ясно — от существования свободных рецепторов боли. Их много в соединительной ткани.
Как бы мы ни пытались «неврализировать» зоны склеро-томных отдач и аналогизировать с дерма- и миотомами, мы неизбежно вынуждены переключиться на скелетно-мышеч-ную, а не невральную терминологию (Попелянский Я.Ю., 2001). Рассмотрим наугад любое описание и трактовку скле-ротомов. Так, в руководстве J.Bonika по боли (2001) табл. №54.3 озаглавлена как «Распространение склеротомов по определенным зонам иннервации». В ее тексте же — ни слова о нервах. Приведем для примера одну строку.
«Сегмент» С$, «склеротом»: позвонок Су, часть плеча, лопатка и проксимальная часть локтевой кости. Суставы: акромио-клавикулярный, глено-гуморальный, Люшка, межпозвонковый, локтевой, зиго-апофизальный, стерно-клавикулярный. Связки: передние и задние продольные, выйная, желтая.
Трудно судить: это «иннервируемые» ткани или механические системы, вовлекаемые в болевую зону? Так, «articula-tio zigoapophysal» связан и со склеротомом Сз, и со склеро-томом Tj.
Только отказ от периферической невральной гипотезы склеротомных болей позволит трезво оценить периферичес-
Глава XI. Патогенез
кие склеротомные топические звенья рисунка болевых «иррадиации»1. Есть основания полагать, что под этим углом зрения следует пересмотреть и сущность зон Захарьина-Геда.
Роль рецепторов соединительной ткани как субстрата болей обсуждалась неоднократно в связи с описанием понятия склеротома.
В настоящее время, с учетом новой модели мышечного сокращения (Ваш А., 1991), при оценке афферентных болевых импульсов из мышцы следует придавать основное значение рецепторам ее соединительнотканных элементов.
Возвращаясь к частному варианту болезненности в зоне локальных мышечных уплотнений, вновь отметим его этапные механизмы.
В условиях пока плохо изученной генетической дефектности под влиянием механических и гуморальных нарушений укорачиваются неконтрактильные элементы мышцы (эндо- и перимизий), происходит перекручивание коллаге-новых волокон с выжиманием воды из мышечных фибрилл. Они укорачиваются при сближении актиновых и миозино-вых нитей, и диаметр данного участка мышцы увеличивается. В этих условиях перерастягиваются нервно-мышечные веретена и подвергаются раздражению свободные («голые») рецепторы соединительнотканных элементов мышцы. Остаточное напряжение поддерживается патологической им-пульсацией из позвоночника или из другой части опорно-двигательного аппарата, или из пораженного внутреннего органа, или из охлажденного участка органа и пр. Усугубляется афферентная дезорганизация импульсов по волокнам И, III, la, возвратное торможение ослабляется, и проторяется путь как для ноцицептивных импульсов из больного участка, так и — особенно — для проприоцептивного рефлекса (Иваничев ГЛ., 1990; Петров К.Б., 2001). Поэтому при сохранности задних канатиков спинного мозга у больных си-рингомиелией поддерживается состояние локального гипертонуса. Здесь искажается архитектоника терминален двигательных единиц — пространственная аберрация. Это состояние поддерживается рефлекторно, аксоплазматичес-кими вегето-сосудистыми нарушениями, анемизацией, изменением химизма, появлением альгогенных веществ. Так формируется болезненный миотонус. В этой как бы функциональной стадии — миотонической (условно называемой альгической) — световым микроскопом изменения не выявляются. Под влиянием вазомоторных и аксоплазматических воздействий формируются более грубые трофические сдвиги. Усугубляются дисциркуляторные нарушения, температура снижается в мышце и повышается в коже, где меняется и потоотделение, и липкость. В мышце меняется сукцинат-дегидрогеназная и АТФ-азная активность, набор изоформ контрактильных и регуляторных протеинов, меняется состав «быстрых» и «медленных» волокон. Эти участки становятся аутоантигенами. Наступает вторая стадия, явно органическая, с более устойчивой зоной отдачи болей. Мы ее условно (но все же неудачно) обозначили как триггерную. Заключительный миофиброз можно рассматривать и как остаточные явления, и как стадию процесса.
Из источников генерации склеротомных импульсов последние направляются преимущественно к местам соединения фиброзных и костных образований. Территория рас-
пространения болевых ощущений при этом зависит не только от расположения сегмента по длиннику позвоночника или конечности, но и от глубины расположения очага, генерирующего боль. Как показал A.Briigger (1967), чем глубже располагается связка, тем дистальнее распространяется боль. Так, введение иглы в заднюю крестцово-под-вздошную связку сопровождалось отдачей болей в ягодицу. Когда же игла продвигалась глубже, боль начинала ощущаться по задне-наружной части бедра, голени и до наружной лодыжки. При анализе болевых ощущений следует учесть и суммацию импульсов из позвоночника с импульсами из внутренних органов, включая сосуды сердца.
Так, например, после инфаркта миокарда в патологическое возбуждение включаются мышцы, составляющие так называемый мышечно-сухожильный меридиан сердца. Это спиралевидная цепь рефлексов передней зубчатой, малой грудной, клюво-плечевой, подлопаточной и др. мышц (По-пелянский Я.Ю. с соавт., 1989; Петров К.Б., 1996). Однако, пользуясь вышеприведенной терминологией А.А.Ухтомского, ничтожная боковая дорожка из порока способна к обширным «взрывам» в тонусе ряда мышц грудной клетки и плеча при суммации с импульсацией из больного диска. Так, у инфарктных больных формируются болевые и тонические синдромы мышц грудной клетки и руки с картиной кардиальгии и плечелопаточного периартроза.
Вегетативные волокна, идущие в составе сосудистых сплетений, распространяются шире дерматомов — в зоне васкуляризации данного сосуда, т.е. в вазотоме (Gross D., 1968). Если поражение вегетативных волокон, идущих в составе соматических нервов, ведет в основном к трофическим нарушениям, поражение волокон вазотома обусловливает больше вазомоторные нарушения (Бантов М., Стай-ков М., 1969), что больше имеет место на первых стадиях заболеваний, сопровождающихся и протопатическими болевыми проявлениями.
Итак, болевые ощущения при остеохондрозе являются преимущественно соматогенными, т.е. вызванными раздражением рецепторов соматических тканей (а не волокон корешка). В указанном же аспекте следует рассмотреть возможность такого же генеза и болей в области сдавленного корешка, т.к. при этом той же грыжей диска и другими структурами раздражаются рецепторы оболочек и других близлежащих тканей. Следует рассмотреть боли и другие сенсорные расстройства, вызванные: а) изменением состояния самих аксонов в зоне корешка, б) раздражением рецепторов тканей, принадлежащих к корешку.
Картина сдавления дотоле нормального нервного ствола — это признаки глубокого выпадения двигательных и чувствительных (а также вегетативных) функций, а отнюдь не боль. Это было показано O.Lindahl в 1947 г. на примере больных туберкулезным спондилитом. Явления же раздражения нервного ствола хорошо известны по ощущениям, которые мы испытываем при ушибе в области локтевого сустава — это больше неприятные парестезии, чем боль.
Другое дело — синдромы остеохондроза, которые всегда являются болевыми. Малоболевые проявления могут быть лишь проявлением определенной стадии.
1 Могут возразить: склеротомные зоны первоначально определялись по явно сегментарным механизмам — боли в конечности при сегментарном раздражении межостистых связок. Однако мы ведем речь не о центральных (сегментарных) путях боли. На любом участке этих путей и связей возможно инициирующее действие ноцицепции. Мы ведем разговор о топике «иррадиации» болей.
Ортопедическая неврология. Этиология, патогенез, диагностика, лечение
Не любая компрессия и компрессия не любого корешка вызывают характерный для «радикулита» болевой синдром. Менингиома или невринома внутри позвоночного канала в трети наблюдений не сопровождается болью, видимо, из-за определенного темпа развития процесса, консистенции и других особенностей процесса. Следует также учесть значительные объемные компенсаторные возможности позвоночного канала — они для содержимого канала в 1,5-2 раза больше, чем в полости черепа (Кисляков Ю.Я., Зеликсон Б.Б., 1973). В пользу подобной трактовки M.Falkoner et al. (1948) приводят пример: у больного с гидактидной околокорешковой кистой не было никаких корешковых симптомов, и лишь травматизация зоны кисты вызывала патологические проявления. При грыже диска же болевой синдром обычно является ведущим. N.Netzel (1968) утверждает: «Это ведь аксиома: если пациент со сдавлением поясничного корешка не жалуется на боль, значит причина компрессии не в выпадении пульпозного ядра» (с. 184). Клинические проявления компрессии корешка могут быть различными в зависимости от ряда условий. Имеются наблюдения, согласно которым грыжа диска и, соответственно, сдавленный корешок могут существовать как бессимптомные находки (Hitselberger W., Wetten R., 1968), после обострения болевых проявлений повторная миелография может показать прежнюю картину грыжи диска в условиях полной ремиссии (Falkoner M. et al, 1948). N.Wetzel (1968) сообщает о больном, у которого удаление диска было произведено на одной стороне, а боли исчезли на другой; он описал также больного с несомненным (в последующем верифицированным) сдавлением корешка грыжей диска, у которого боль исчезла после мнимой операции — была разрезана лишь кожа.
R.Semmes (1964) показал, что прикосновение к пораженному корешку на уровне грыжи диска воспроизводит спонтанные болевые ощущения данного пациента, тогда как раздражение соседних здоровых корешков сопровождается лишь пронизывающим ощущением электрического тока. Подобные наблюдения относительно сдавления корешка желтой связкой в 1948 г. сделал W.Waris, а относительно боли, возникающей лишь в гиперальгезированных корешках при эпидурите, писали O.Lindhal (1966) и Я.К.Асс (1971). Напомним, что в экспериментах M.Smyth и F.Wright (1958) потягивание за нити, подведенные под корешки на уровне удаленной грыжи, сопровождалось воспроизведением привычной для каждого больного боли. Но если нить подводилась под здоровый корешок (ранее не подвергавшийся сдав-лению), боль оказывалась значительно слабее. Таким образом, и эти эксперименты указывают на особое состояние корешка, способного вызвать характерную боль, — это корешок предварительно измененной сенситивности. Необходимая для реализации болевого синдрома предварительная ранимость корешка может быть подготовлена рядом факторов. Так, постоянная микротравматизация корешка (и его оболочек) грыжей и другими структурами патологически измененного позвоночника — дискорадикулярный конфликт — возникает в области пораженной части позвоночника, т.е. органа, постоянно подвергающегося статико-динамическим нагрузкам. В этих условиях, видимо, нарушается изоляция различных аксонов в корешке.
R.Granit (1944) показал, что при повреждении или компрессии переднего корешка кошки, даже при легкой компрессии в 50-100 г, нарушается проводимость позади места
компрессии. При этом, однако, появляется новое взаимодействие, как бы артефактный синапс с задним корешком, в котором появляется соответствующая электрическая активность как следствие патологического его возбуждения. Исключительно интересными оказались исследования В.М.Хаютина (1965), углубившие представления о возможной причине повышения ранимости нервных стволов. Он показал, что определенные дозы химических агентов, включая и такие органические вещества, как ацетилхолин, бра-дикинин, никотин, способны вызвать раздражение уже не только рецепторов, но и нервных проводников. Боль, по мнению автора, появляется только в последнем случае как результат синхронизации импульсов.
Таким образом, меняющийся химизм тканей в местах микротравматизации корешка может способствовать превращению адекватной химической сигнализации в сигнализацию болевую, проводимую через измененные осевые цилиндры. Такие измененные осевые цилиндры становятся как бы «рецепторами боли». О том, что нервное волокно может превратиться из проводника в генератор импульсов, говорят и данные о роли посттравматических невром (WallP.D., Gutnick M.,1974; LoeserJ.D., 1985).
Следует учесть, что в перехватах Ранвье, где отсутствует миелиновая изоляция, плотность натриевых каналов в 200 раз больше, чем на остальных участках. В этих перехватах компрессия и способна вызвать потенциал действия. Импульсы «перескакивают» («сальто») до следующего перехвата, сохраняя свою мощность. Интересно, что при отсутствии миелина, при несальтаторной проводимости мощность импульсации начинает уменьшаться, теряясь в межклеточной жидкости. При сближении волокон возможно и «короткое замыкание» (эфаптическая передача).
В связи с этим приобретают значение все морфологические нарушения в корешках, притом не только в условиях травматизации или других экзогенных воздействий. Это касается, в частности, возрастных изменений в корешках, т.к. «радикулит» — это практически проблема не детского, а зрелого возраста. В пожилом же возрасте, как известно, корешковые явления смягчаются. Это происходит частично вследствие уменьшения травматизации нервных структур грыжей, а частично, судя по течению заболевания, — из-за состояния самих корешков, их «готовности» проводить боль.
В пожилом возрасте происходит деструкция миелина. Дериваты выносятся за пределы нервных стволов (возможна и ремиелинизация, что зависит от состояния оболочек). Постепенное нарастание периаксональных изменений к 55-60 годам приводит к патологическим нарушениям и в аксоне. Одновременно развертываются патологические процессы и в сосудах нерва, накапливаются элементы соединительной ткани в оболочках нервных стволов, что приводит к изменению функционального состояния этих стволов (Головченко Ю.И., 1971). Соответственно этому замедляется ритм импульсации, уменьшается длительность и амплитуда потенциала, удлиняется латентный период. Порог возбуждения не понижается, а повышается (Подруш-няк Е.П., Янковская А.С., 1969). Поэтому не у всех пожилых с описанными морфологическими изменениями нервных стволов, в частности бокового кожного нерва бедра, возникают боли — дело отнюдь не в одних лишь дегенеративных изменениях нерва.
Глава XI. Патогенез
Некоторые авторы, как уже упоминалось, описывают вертеброгенный «негрыжевой радикулит» (Рутенбург М.Д., 1973, 1977) за счет экзостозов, смещенной желтой связки, диффузного выпячивания диска или сдавления в боковом рецессусе («скрытый позвоночный стеноз» по Choudury A., Taylor Y., 1977), за счет сгибания корешкового корня дужки или суставного отростка (Macnab J., 1974). При компрессии корешка первыми поражаются афференты типа А. Напомним, что, согласно данным H.Head (1893), R.Melzak и P.Wall (1965), Т.И.Крыжановского (1980), М.Л.Старобинца (1981) и др., при поражении этих проводников эпикритической чувствительности уменьшаются пресинаптические тормозные интернейронные «воротные» сторожевые влияния; происходит антидромная активация ноцицепторов в районе периферического распределения волокон сдавленного корешка. Истощается и функция нисходящих антиноцицеп-тивных систем, активизируемых морфиноподобными веществами — энкефалинами. В спинномозговой жидкости снижено содержание первой фракции эндорфинов (Wahlstrom А., 1978). Механизм сегментарно-интерсегмен-тарных корешковых болей — это, во-первых, устранение ингибиторного контроля в ряде систем: специфических ин-гибиторных нейронов, антиболевых нейрональных систем, в системе супрасегментарного моторного контроля, а во-вторых, механизмы деафферентации.
Истинные корешковые боли испытываются в зоне дер-матома. Болезненность корешка, как и другой части нервного ствола, от давления, растяжения (в частности и кост-но-хрящевыми структурами) испытывается в небольшой зоне вследствие раздражения свободных болевых рецепторов оболочек нерва. Все это касается истинно корешковых болей. Однако существует ошибочная тенденция считать корешок единственной причиной болей при остеохондрозе. Допускают, что боль, не укладывающаяся в территорию дер-матома, все же всегда является корешковой — за счет нескольких корешков. Я.К.Асс (1971) писал о том же относительно асептического вертеброгенного эпидурита. Как оперативные находки автора, так и контрастно-рентгенологические данные (Дмитриева A.M., 1966; Чаплыгин В.И., 1972), равно как и результаты гистологических исследований (Кочетков Ю. Т., 1969), говорят о не столь уж редких при грыже поясничного диска эпидуральных спайках. Не следует, однако, считать, что эпидуральные спайки всегда ведут к появлению корешковой симптоматики. Механическую роль Рубцовых изменений (как факторов компрессии корешка и соответствующих расстройств чувствительности) не следует преувеличивать. Как справедливо замечает З.Кунц (1951), послеоперационные спайки в области корешка при удалении грыжи диска обычно не дают корешковых болевых синдромов. Значение имеют, видимо, явления венозного застоя и отека корешка, реактивно-воспалительные изменения (Dandy W., 1941; Falkoner M. et al, 1948; Habermann H., 1949; Irsigler К, 1951; Lindahl О., Rexed В., 1951; Berg A., 1953; Шустин В.А., Панюшкин A.M., 1985; Rosen H., 1974; Фарбер М.А., 1975 и др.), связанные с рядом патологических факторов, которые мы еще плохо знаем. Реактивный «эпидурит» и, в особенности, реактивный «арахноидит» при остеохондрозе все же оказывает существенное влияние на клиническую картину (Никидзе Т.К., Гоцирид-зеДА., 1957; Асе Я.К, 1971; Михеев В.В. с соавт., 1972; Про-хорский A.M., Якимов В.П., 1973;Лерман В.И., 1973). Если же
эти проявления спаечного процесса в тех случаях, когда они действительно имеют место, обусловлены не только и не столько компрессионным воздействием на корешки, то чем же иным они обусловлены? Какими иными немеханическими факторами?
Можно считать установленным, что важное место среди этих факторов занимают сенсибилизация околопозвоночных (включая корешковые) тканей, иммуно-морфологиче-ские и биохимические сдвиги в области пораженного диска и во всем организме. О сенсибилизации тканей корешка в условиях разрушения диска говорит и важный факт, который нам приходилось наблюдать при папаинотерапии остеохондроза. На второй-третьей неделе после введения этого фермента в пораженный диск иногда возникают судороги поясничных мышц и их болезненность, общее недомогание, гипертермия — развивается состояние повышенной чретвительности к разрушенному веществу диска (Калин-кин В.Е. с соавт., 1969). При этом иногда отмечали появление гиперпатии в зоне иннервации соответствующего корешка. Видимо, нарушается изоляция отдельных аксонов, создаются условия для гиперсинхронизации и для того, чтобы поврежденные аксоны стали «рецепторами боли». Таким образом, если при остеохондрозе боль по своему происхождению является корешковой, она возникает при этом лишь в условиях определенного состояния корешка. Без этого или нет боли, или нет характерной для остеохондроза боли.
Все сказанное выше о формах вовлечения корешка при спаечных процессах касается тех компонентов болевого синдрома, которые связаны с участием измененных нервных стволов. О них следует помнить, когда в клинических проявлениях выступают нарушения со стороны конкретных мио- и дерматомов, т.е. когда наблюдается картина корешкового поражения. Чаще, однако, как следует из неоднократно упоминавшихся данных, симптоматика у лиц со спаечным процессом не укладывается в картину корешковой патологии. Это те же рефлекторные мышечно-тонические, нейродистрофические и вазомоторные нарушения. Т.к. развитие их по времени и локализации связано со спаечным процессом, следует предположить, что последний и является источником этих рефлекторных синдромов. Мы полагаем, что спайки выступают не только как фактор механического воздействия, изменяющего также и крово- и лимфообращение, но как фактор рецепторный, как источник патологической импульсации. Одним из результатов ее являются болевые ощущения. Реальность этого механизма подтверждается наблюдениями R.Frykholm (1951) и других нейрохирургов: на операционном столе смещение оболочки в зоне дурорадикулярного соединения сопровождается рез-чайшей болью, притом не в зоне корешка, а во всей конечности. Для объяснения такой большой территории боли привлекают феномен пространственной суммации, осуществляющейся в спиноталамическом пути (Droogleever F., 1949). Учитывая, однако, некорешковые, несегментарные территории болей в ноге при спаечно-эпидуральном процессе и такую же зону других (рефлекторных) проявлений, следует признать и другой механизм, а именно раздражение рецепторов в области спаечно измененных оболочек. Патологические импульсы из пораженных оболочечных тканей, направляясь к центрам, видимо, и вызывают боль и становятся источником рефлекторных ответов.
Ортопедическая неврология. Этиология, патогенез, диагностика, лечение
По мере наблюдения за больными вырисовывалось представление о двух типах боли при пояснично-крестцо-вых и шейно-грудных синдромах. Первый тип боли — «ра-дикулальгия» — кинжально острая, стреляющая, приступообразная, распространяющаяся по всему дерматому до дис-тальных отделов, проводящаяся задними корешками. Второй тип — «фибральгия» и «миальгия» — ощущающаяся в глубине, усиливающаяся при давлении или растяжении пораженных тканей, грызущая или мозжащая, распространяющаяся не до самого дистального отдела дерматома, локализующаяся в отдельных зонах и весьма постоянная, проводящаяся сложными нервными путями, в том числе, видимо, и «чувствительными» волокнами передних корешков (Shaw R., 1923, 1924; Norlen G, 1944; Sahlgren К, 1946; Michelsen J., Mixten W., 1946; Ftykholm R., 1951). Подобным же источником могут стать и рецепторы позвоночного сегмента с его фиброзными тканями, включая и оболочечные, и спаечные. Развитие этих взглядов связано с учением о склеротомах.
Механизм формирования болевых ощущений, отраженных от зон нейроостео- и нейромиофиброза, остается тайным. Это иррадиации (иррадиационный, ирритативный или реактивный синдром по Маркелову), находящие свое отражение в головном мозгу. Субстрат соответствующих энергетических токов в зонах нейроостеофиброза и вокруг них и микроскопические пути указанных токов не ясны. Опираясь на концепции «эмбриогенетического следа», ос-тео- и склероневральных отношений (Fuye R., 1956; Михайлов И.В., 1985; Roth M., 1985; Ахмеров НУ., 1991), можно полагать, что эти субстраты и пути не нервные, а соединительнотканные, костные — мезодермальные или другие межклеточные. Эмбриологически они донервные, древние, «оживающие» в условиях локальной и центрально-нервной патологии.
Мы остановились на вопросах патогенеза болевых ощущений при остеохондрозе. Раз возникнув, эти ощущения сказываются на самочувствии больного, на гуморальных процессах и структурах центральной нервной системы.
Выше упоминалось о частом сочетании синдромов беспокойных ног с депрессией. Но и миальгии вообще часто оказываются связанными с психическими переживаниями. Психогенный ревматизм, психогенные миальгии включаются почти во все классификационные схемы по ревматизму. K.Mills и R.Edwards (1983), находившие ферментативные и другие биохимические нарушения в биоптатах больных миальгией, оценивали у 2/3 больных эту миальгию как психогенную. Все указанные нарушения на периферии в мышцах (при миальгии) должны учитываться наряду с нарушениями центральными. З.Миржатски и соавт. (1964) установили, что у больных поясничным остеохондрозом быстро образуются и легко фиксируются болевые и условные рефлексы: тактильные и звуковые условные раздражители легко фиксировались и нередко долго сохранялись после ликвидации корешковой компрессии (в качестве безусловного стимула применялись электрические раздражители кожи и прием Ласега). Если под влиянием кратковременного болезненного растяжения тканей (симптом Ласега) условные рефлексы образуются легко, то длительное статическое напряжение тормозит всякие условные рефлексы (Могендо-вич М.Р., 1957). По мнению L.R.Hubbard (1996), боль и слова команды из инграмм старых латентных периферических
очагов («Вот так всегда и болит» или «Я влип») включают гуморальные команды. Возникают местные эндокринно-гу-моральные изменения, «рестимуляция» в тканях. Требуются дальнейшие исследования влияния болевых импульсов из позвоночника и других тканей на судьбу мышечнотоничес-ких, нейродистрофических и нейрососудистых сдвигов при остеохондрозе.
Таким образом, в патогенезе остеохондроза и его симптомов важное место занимают врожденные и приобретенные структурные изменения в опорно-двигательном аппарате квадранта, иннервационно связанном с пораженным позвоночным сегментом. Патологическая импульсация из пораженных позвоночных и внепозвоночных тканей, как болевая, так и неболевая и субсенсорная, в свою очередь, сказывается на состоянии мышц позвоночника и соответствующего квадранта тела. Это патологическое кольцо замыкается не только на спинальном, но и на стволовом и корковом уровнях. Отсюда место супраспинальных влияний в патогенезе остеохондроза. Как на трофических процессах и вазо-моторике в пораженных тканях, так, в особенности, и на координации мышц позвоночника неизменно сказываются эмоциональные и другие психические влияния, центральные и периферические нервно-гуморальные влияния.
При диагностической и патогенетической оценке боли и болезненности приходится учитывать их субъективный характер: болевая импульсация перерабатывается психически. Рассмотрим это на следующем примере.
В руководстве «The Pediatric Spine», N.Y., 1994, на стр. 1941 авторами, ортопедами, приводятся следующие «неорганические физические признаки боли в спине» — «Wadell's test» (Wadell G. et al., Nonorganic physical signs in low-back pain Spine, 1980,5:117-25), всего 5 тестов.
Тест 1. «Болезненность».Признак может оцениваться как положительный, когда больной сообщает о боли при легком прикосновении или «прокатывании» кожи спины, или если глубокая болезненность распространяется на широкую зону тела.
Попытка патогенетической оценки («неорганический» признак) рискованна: оценка делается на основании якобы отсутствующей «органической», а одной лишь центральной, «психической», природы ощущений. Между тем изменения типа нейроостеофиброза в периферических тканях относятся к разряду органических; суммация происходит с импульсацией из органически измененного позвоночника. Распространение на широкую зону тела нередко обусловлено дополнительными импульсами из органически измененных внутренних органов.
Тест 2. «На симуляцию».Этот тест может оцениваться как положительный, если легкое аксиальное вращение тазового и плечевого пояса вызывает боль или если боль (1в) возникает в голове, когда врач пальпирует спину.
И в данном случае возможна гипердиагностика психического компонента (симуляция или истерическое внушение). Ротационное движение в тазовом и плечевом поясе действительно обеспечивает покой, так сказать, в ортопедическом смысле. Однако оно сопровождается координатор-ным откликом за пределами указанных поясов: синергичес-ких, реципрокных и др. — кроме отклика психического.
Тест 3. «Тест растяжения».Этот тест авторы считают положительным, если больной жалуется на боль при активных движениях.
Глава XI. Патогенез
Однако боль не появляется при той же активности, при том же растяжении тканей, но при движении «в другом контексте». Так, например, симптом растяжения (Laseques) может быть положительным, когда больной лежит на спине, но отсутствует при подобном растяжении в положении пациента сидя.
Комментарий тот же, что и в отношении предыдущего теста.
Тест 4. «Региональные нарушения».О них говорят тогда, когда у пациента обнаруживается или слабость по типу «отдачи зубчатым колесом» при нарастающем сопротивлении активному движению, или ощущение онемения отмечается в определенном регионе, например, в зоне носков или перчаток при отсутствии полинейропатии.
И в данном случае болевое поведение тоже необязательно является «психологическим». Подобные «ампутационные» зоны расстройств отмечали при органической патологии мозга при вегетативной патологии на периферии (Грин-штейн A.M., 1971).
Тест 5. «Гиперреактивность».Этот признак считается положительным, когда появляются невербальная выразительная активность в форме гримас, выкриков, стонов, тремора, обмороков, пота или спотыканий.
И подобного рода гиперкинетические реакции описаны при вертеброгенных болях у больных с наличием дополнительных очагов (органических) как на периферии, так и в центре (Попелянский Я.Ю. и соавт., 1998).
Авторы заключают: если положительны три из перечисленных пяти тестов, можно говорить о неорганическом — психологическом — характере болевого поведения.
Мы полагаем, что такое алгоритмирование в отношении неуточненных патогенетических понятий относится к воз-
ведению икс'а в N-ю степень. Оно оправдано в отношении анатомически конечных структур (объект ортопедии) и рискованно в отношении ортопедоневрологических понятий.
Процесс в позвоночнике начинается как преимущественно церебросоматический, дискоординационный, а в дальнейшем этот процесс и его клинические проявления протекают с участием посттравматических механизмов.
Таким образом, мы еще далеки от современной теории остеохондроза и синдромов вертеброгенных заболеваний. В учебном процессе говорят о факторах, вызывающих и способствующих. К первым относят компрессионные, фиксирующие или дисфиксирующие, дисгемические и инфекционные. Ко вторым относят нейрогенные, опорно-двигательные (аномалии, приобретенные особенности моторики, реципрокность, пирамидные, экстрапирамидные, лобные), вегетативные, покровно-тканные, аллергические. Однако между схемами, удобными для обучения студентов, и теми, в которых мы нуждаемся для развития совершенного знания о патогенезе, — большая дистанция.
В упомянутой схеме почти все сомнительно, начиная от смещения критериев. Нельзя считать первым вызывающим фактором компрессию — она лишь одна из стадий процесса. Нейрогенный фактор не должен быть отнесен к способствующим — это фактор миофиксации, который был принят не за способствующий, а за вызывающий. То же относится к дисгемическому и воспалительному факторам. Пессимистическая правда заключается в том, что глубоко научная концепция патогенеза остеохондроза и других вертеброгенных синдромов — дело будущего, сегодня ее еще нет.
Дата добавления: 2015-04-07; просмотров: 1443;
