Синтез фторированных углеводородов
1. Тетрафторэтилен F2C=CF2, газ, tкип = –76оС
Получают пиролизом монохлордифторметана при 650-700оС в графитовых, стеклянных или серебряных трубках:
2CHClF2 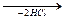 2·CF2· → F2C=CF2
2·CF2· → F2C=CF2
Является мономером политетрафторэтилена (фторопласт–4).
2. ТрифторхлорэтиленClFC=CF2, газ, tкип = –27оС
Получают взаимодействием спиртового раствора 1,1,2-трифтортрихлорэтана с цинком:
Cl2FC–CClF2 + Zn → ClFC=CF2 + ZnCl2
Является мономером полихлортрифторэтилена (фторопласт – 3).
3. Фреоны. Фреонами называются хлорфторпроизводные метана и этана. Это газообразные вещества или низкокипящие жидкости со слабым запахом, малотоксичные и негорючие. Такие свойства обеспечили их широкое применение в качестве хладореагентов, особенно для бытовых целей и в качестве аэрозольных растворителей.
Для фреонов установлены сокращенные названия, соответствующие их эмпирическому составу (фреон–12, фреон–113 и т.д.):
– Последняя цифра указывает на число атомов фтора;
– Вторая справа – на 1 больше числа атомов водорода;
– Первая слева на 1 меньше числа атомов углерода;
Так, во фреоне–12 два атома фтора, нет ни одного атома водорода и один атом углерода, что дает формулу CCl2F2.
Важнейшие фреоны получают в промышленности замещением атомов хлора на атомы фтора в хлороформе, четыреххлористом углероде, тетра-, пента- и гексахлорэтане и при взаимодействии последних с HF в присутствии катализатора (галогенидов сурьмы). Причем для получения определенных продуктов выбирают условия реакции таким образом, чтобы исходные вещества находились в виде жидкостей, а продукты легко отгонялись по мере образования.
Схемы процессов следующие:
CHCl3 → CHCl2F → CHClF2 → CHF3
фреон-21 фреон-22 фреон-23
tкип = +9оС –41оС –82оС
CCl4 → CCl3F → CH2F2 → CClF3
фреон-11 фреон-12 фреон-13
+24оС –30оС –82оС
СH3–CH3 → Cl2FC–CClF2 → ClF2C–CClF2 → ClF2C–CF3
фреон-113 фреон-114 фреон-115
+48оС +4оС –38оС
Полученные вещества находят следующее применение:
CHCl3 – является хорошим метилирующим агентом, например для получения диметилдихлорсилана (СH3)2SiCl2, метилмеркаптана CH3SH и т.д.
CH2Сl2 и CCl4 – превосходные растворители. Применение для этой цели хлороформа ограничено его высокой токсичностью.
CHCl3 используется как промежуточный продукт для синтезов

CCl4 кроме того используется для производства фреона–12
CCl4 + 2HF 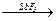 CCl2F2 + 2HCl
CCl2F2 + 2HCl
и тушения пожаров электропроводки.
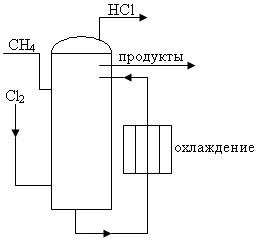
Процесс жидкого хлорирования состоит в том, что хлор барботирует через жидкую реакционную массу. Реакция протекает в растворе. Образующийся HCl десорбируется и удаляется в виде газа. Продукты накапливаются в растворе, и затем их ректифицируют. В хлораторе предусмотрено обязательное облучение и охлаждение.
Дата добавления: 2015-06-17; просмотров: 1284;
