Хлорирование метана
Процессы хлорирования метановых углеводородов и их галогенопроизводных принадлежит к радикально-цепным реакциям.
Зарождение цепи, состоящее в образовании свободных атомов хлора, может протекать следующим образом:
1. Термическое инициирование:
Cl2 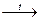 Cl· +Cl·адс
Cl· +Cl·адс
Температура, необходимая для реакции составляет 250-500оС.
2. Фотоинициирование:
Cl2 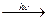 2Cl·
2Cl·
Наиболее эффективен свет c λ = 3400 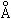 (УФ).
(УФ).
3. Применение инициаторов:
(С6Н5-СОО)2  2С6Н5СОО·
2С6Н5СОО·  2С6Н5· + 2СО2
2С6Н5· + 2СО2
перекись бензоила
С6Н5· + Сl2  C6H5Cl + Cl·
C6H5Cl + Cl·
Развитие цепи осуществляется следующим образом:
Сl· + RH 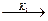 R· + HCl
R· + HCl
R· + Cl2 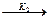 RCl + Cl·
RCl + Cl·
В производственных условиях длина цепи достигает нескольких сотен звеньев.
Обрыв цепипри газофазном галогенировании:
Сl· → Cl·адс
при жидкофазном – обрыв квадратичен:
2Сl· → Cl2
R· + Cl· → RCl
При этом константа общей скорости процесса является функцией констант скорости зарождения, развития и обрыва цепи. Поскольку энергии активации при реакциях свободных радикалов невелики, то лимитирующей является стадия зарождения цепи. Скорость данного процесса мало зависит от температуры, и его можно проводить при низких температурах. Интенсификация состоит в увеличении интенсивности облучения.
В молекулах алканов под действием атомов хлора могут замещаться один за другим несколько атомов водорода, что приводит к образованию продуктов различной степени галогенирования. Так из метана можно получить следующие вещества:
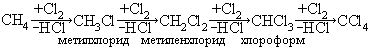
Состав продуктов при необратимых последовательно-параллельных реакциях определяется соотношением исходных веществ и соотношением констант скорости.
Для метана
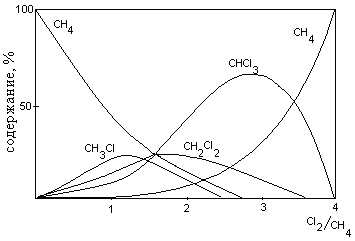
При этом первые два продукта получаются при газофазном хлорировании метана, а два последних – при жидкофазном.
Синтез дихлорэтана С2H4Cl2
1,2 дихлорэтан – жидкость, toкип = 84 оС. Является хорошим растворителем, особенно оргстекла – полиметилметакрилата. Кроме того, используется в следующих синтезах:
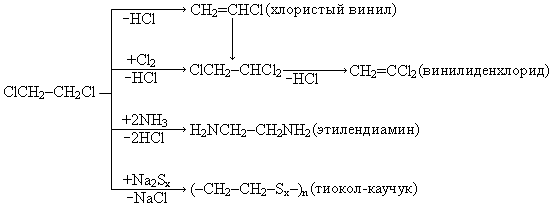
В промышленности получают исключительно при жидкофазном хлорировании этилена, т.к. другие пути синтеза (в хлорировании этана) связаны с лишним расходом хлора и образованием побочных продуктов.
Кроме этого пути в последнее время приобретает значение окислительное хлорирование этилена. Благодаря поддержанию низкой температуры (260-280оС) процесс на медьхлоридном катализаторе сводится только к присоединению хлора.
2HCl + 0,5O2 = Cl2 + H2O
CH2=CH2 + Cl2 = ClCH2–CH2Cl
Это производство сочетается с термическим дегидрохлорированием дихлорэтана в хлористый винил.
С технологической точки зрения наиболее удобный способ проведения жидкофазного процесса с участием двух газообразных реагентов состоит в их барботировании через продукт реакции. В нашем случае этилен и хлор барботируют через дихлорэтан. Растворяясь в продукте реакции, газы реагируют друг с другом в растворе, причем количество жидкости непрерывно увеличивается.
Этот метод применим в тех случаях, когда целевой продукт не вступает в последующие реакции с образованием побочных продуктов. Расход продуктов идет строго по стехиометрии, требуется лишь небольшой избыток (примерно 5%) углеводородов, чтобы повысить степень превращения более дорогого хлора.
Температура процесса поддерживается на уровне 40-60оС с применением ингибиторов радикально-цепного замещения и с использованием реакторов-хлораторов, подробно рассмотреных ранее.
Синтез хлорвинила СH2=CHCl
Хлористый винил – бесцветный газ, tкип = –14оС. Один из важнейших мономеров, из которого полимеризацией получают винипласт пленку, искусственную кожу, перхлорвиниловую смолу и т.д. Из сополимеров хлористого винила с винилиденхлоридом CH2=CCl2 и акрилонитрилом CH2=CHCN вырабатывают синтетические волокна.
Существует несколько способов синтеза хлористого винила:
1. Термическое дегидрохлорирование 1,2-дихлорэтана
ClCH2–CH2Cl 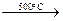 CH2=CHCl + НСl
CH2=CHCl + НСl
2. Гидрохлорирование ацетилена
СН≡СН + HCl 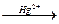 CH2=CHCl
CH2=CHCl
3. Комбинированные методы
Сочетание хлорирования этилена с дегидрохлорированием дихлорэтана и гидрохлорированием ацетилена
CH2=CH2 + Cl2 = ClCH2–CH2Cl
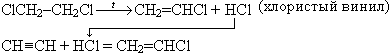
Этот метод является экономичным и перспективным для промышленного внедрения, особенно если использовать пиролизный газ, содержащий этилен, ацетилен и очищенный только от сажи, высших гомологов ацетилена и СО2.
Основным методом в настоящее время остается каталитическое селективное гидрохлорирование ацетилена:
СН≡СН + HCl 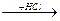 CH2=CHCl + HCl
CH2=CHCl + HCl 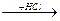 CH3–CHCl2
CH3–CHCl2
Подбирают катализаторы, ускоряющие только первую стадию присоединения. Для этой цели эффективны соли HgCl2 и Сu2Cl2. Т.к. сулема является катализатором реакции гидратации ацетилена, то HgCl2 используют только в газофазном гидрохлорировании сухих реагентов при 150-200оС. Катализатор готовится путем пропитки активированного угля водным раствором сулемы с последующей сушкой.
Вследствие высокой экзотермичности процесс проводят в трубчатых реакторах. В трубах находится катализатор и движется газовая смесь, а в межтрубном пространстве циркулирует охлаждающий агент, в основном вода. Степень конверсии ацетилена за один проход составляет 97-98%, а реакционные газы содержат 93% хлористого винила, 5% НСl и остальное – ацетилен, этилиденхлорид и ацетальдегид. Газы промывают щелочью и, после удаления HCl, ректифицируют.
Для жидкофазного гидрохлорирования используют в качестве катализатора раствор Сu2Cl2 в HCl.
Побочным процессом здесь является димеризация ацетилена. Для подавления этой реакции необходимо использовать концентрированную НСl и все время добавлять хлороводород в раствор.
Дата добавления: 2015-06-17; просмотров: 4783;
