УГЛЕКИСЛОТНАЯ КОНВЕРСИЯ МЕТАНА, ПРИМЕНЯЕМЫЕ КАТАЛИЗАТОРЫ. ПАРЦИАЛЬНОЕ ОКИСЛЕНИЕ МЕТАНА. НОВЫЕ МОДИФИКАЦИИ ПРОЦЕССА ПОЛУЧЕНИЯ СИНТЕЗ-ГАЗА
¯ Углекислотная конверсия.
Используется в промышленности гораздо реже паровой. Однако этот метод позволяет получать синтез-газ с мольным отношением СО : Н2=1:1. Газ такого состава нужен для гидроформилирования, получения формальдегида или поликарбонатов. Используя комбинацию углекислотной и паровой конверсии, можно получать синтез-газ практически любого состава.
Углекислотная конверсия позволяет также вовлекать в синтез диоксид углерода, запасы которого огромны, а масштабы использования в промышленности невелики (в основном для производства соды, мочевины и салициловой кислоты), поэтому расширение числа синтезов на основе СО2 – перспективное направление развития газохимии.
Углекислотная конверсия метана протекает с бо́льшим поглощением тепла, чем паровая конверсия. Селективности и конверсии, близкие к 100%, достигаются при 1000-1100°С. При температуре ниже 640°С равновесие реакции сдвинуто в сторону образования СН4 + СО2 (протекает метанирование СО).
Помимо основной реакции при углекислотной конверсии метана протекает реакция образования углерода:
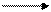 СН4+ 2СО2 С + 2СО + Н2О (DН = +641 кДж/моль),
СН4+ 2СО2 С + 2СО + Н2О (DН = +641 кДж/моль),
Эта реакция является эндотермической и протекает при высоких температурах.
Катализаторыуглекислотной конверсии метана - металлы и их оксиды.
Из числа металлических катализаторов наибольшую активность проявляют металлы VIII группы. Она снижается в ряду: Rh>Pt>Pd~Ir>Ru. Они также менее подвержены зауглероживанию. Активность благородных металлов определяется примененным носителем, способствующим их диспергации на поверхности. Активность катализаторов, содержащих один и тот же металл и разные оксиды в углекислотной конверсии метана уменьшается в ряду Al2O3>ThO2>SiO2>MgO, соответствующем изменению кислотности носителя, способствующей образованию более мелких кристаллитов металла. Из неблагородных металлов наибольшей активностью характеризуется никель. Однако повышение температуры синтеза приводит к его закоксовыванию. Снизить этот эффект возможно, добавляя небольшие количества благородных металлов (~0,01-2%) к никелевому катализатору.
В качестве оксидных катализаторов можно использовать индивидуальные (например, MgO, СеО2) и смешанные оксиды.
¯ Парциальное окисление метана.
При этом методе используют никелевые катализаторы, работающие при атмосферном давлении и температуре 750-900°С. В разных слоях реактора наблюдается:
- в верхних слоях - экзотермическую реакцию глубокого окисления
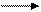 СН4 + 2О2 СО2 + Н2О (DН = -802 кДж.моль)
СН4 + 2О2 СО2 + Н2О (DН = -802 кДж.моль)
- в нижних слоях - эндотермическую реакцию углекислотной конверсии
 СН4 + СО2 2СО + 2Н2 (DН = +261 кДж.моль)
СН4 + СО2 2СО + 2Н2 (DН = +261 кДж.моль)
К недостаткам метода можно отнести :
-высокую стоимость кислорода (~50% от общей величины),
-взрывоопасность,
-возможность разрушения катализатора за счет локальных перегревов,
-возможность образования углерода за счет газофазных реакций.
Парциальное окисление метана в синтез-газ благоприятно во всем интервале температур и могло бы дать 100%-ную конверсию, если бы не другие реакции, в частности, конверсия водяного газа и ее обратная реакция (гидрирование СО2), а также реакции окисления метана:
 СН4 + О2 СО2 + Н2
СН4 + О2 СО2 + Н2
 СН4 + 1,5О2 СО + 2Н2О.
СН4 + 1,5О2 СО + 2Н2О.
Наиболее полная конверсия метана при мольном отношении СН4:О2=2:1 достигается при температуре выше 750°С.
Различают парциальное окисление метана в объеме (гомогенное окисление) и на катализаторе.
Гомогенное окисление метана является единственным промышленным процессом получения синтез-газа парциальным окислением. Этот процесс некаталитический. Реакция протекает при температуре 1100-1300°С до достижения термодинамического равновесия. После удаления Н2S и СО2 синтез-газ имеет состав СО:Н2=1:2.
Каталитическое окисление метана может быть использовано для понижения температуры процесса. Как и в паровой конверсии, для этой цели могут использоваться никелевые катализаторы.
Парциальное окисление при малом времени контакта. Высокие объемные скорости (10000 ч-1 и выше) обеспечивают хорошее смешение и минимальное влияние массопереноса. Малое время контакта может быть достигнуто при пропускании реакционной смеси через керамические блоки с нанесенным на них металлом - катализатором или через металлические сетки.
Малое время контакта (от 10-5 до 10-1 с) позволяет осуществлять процесс с высокой селективностью по синтез-газу (выше 90%) при почти полной конверсии метана. В этом случае метан окисляется по "прямому" механизму, минуя реакции глубокого окисления, паровой и углекислотной конверсии, которые требуют большего времени контакта. Такое проведение процесса является более перспективным, поскольку позволяет сократить размеры аппарата и, возможно, снизить тепловые нагрузки.
Дата добавления: 2015-04-15; просмотров: 6472;
