Протеины и протеиды- одно и тоже.
Белки. Структура и функции
NOTA BENE! Карбонильная группа <С=О, входит в состав альдегидов.
Вместе с гидроксильной группой ОН, образует карбоксильную группу СООН.
Протеины и протеиды- одно и тоже.
Строение аминокислот:
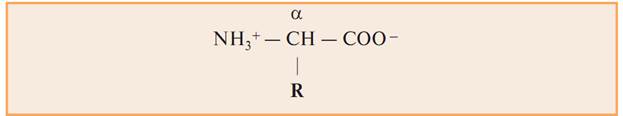
При РН=7, в растворах аминокислоты становятся биполярными ионами.
Все 20 аминокислот, встречающихся в белках, — это α-аминокислоты, общим признаком которых является наличие аминогруппы – NН2 и карбоксильной группы — СООН у α-углеродного атома.
Исключением является пролин, который содержит в α-положении группу — NH и называется иминокислотой. Радикал соединен с аминогруппой,молекула имеет циклическое строение.
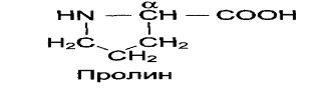
Альфа- атом углерода связан с 4 замещающими группами сразу (-NH2, -COOH, -R, -H).
Могут встречаться изомерные формы аминокислот L и D (dexter)-изомеры. (кроме глицина).
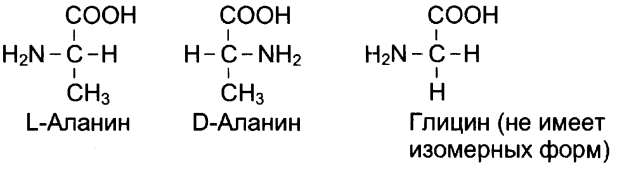
В организмах присутствуют только L-изомеры аминокислот.
Классификация аминокислот по радикалу:
1. Алифатические (линейные), состоят из групп:
-СООН-карбоксильная
-NH2-аминогруппа
-SH-тиольная
-СО-NH2-амидная (пептидная)
-ОН-гидроксильная
-гуанидиновая
2.Ароматические.
3.Гетероциклические.
Классификация по растворимости в воде радикалов:

В растворе неполярные радикалы стремятся друг к другу, или к другим неполярным радикалам.
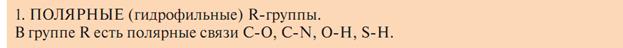

А) Полярные незаряженные радикалы имеют полярные функциональные группы, образующие водородные связи с водой.
Б) Полярные заряженные отрицательно радикалы. Аспаргиновая и глутаминовая кислоты, имеют в радикале дополнительные СООН группы. При РН=7, они диссоциируют на СОО- и Н+ (радикалы-анионы). Ионизированная форма глутаминовой и аспаргиновой кислот называются глутаматом и аспартатом.
В) Аминокислоты с полярными положительно-заряженными радикалами (лизин и аргинин).
Лизин имеет дополнительную аминогруппу и способен принимать Н+, становясь положительно заряженным.
Аргинин за счет гуанидиновой группы тоже становится заряженным положительно.
Гистидин за счет имидозольной группы при РН=7, заряжается либо нейтрально, либо положительно.
Полярно заряженные радикалы аминокислот наиболее растворимы в воде.
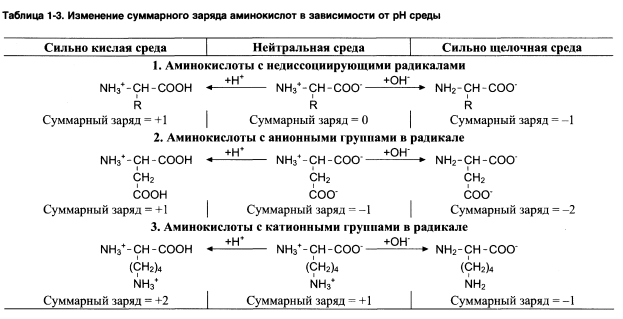
Зависимость заряда от РН:
1.При РН=7 заряд аминокислот=0, если они имеют недиссоциируемый радикал.
2.Заряд (-), если при РН=7 аминокислоты содержат кислотные функциональные группы.
3.Заряд (+), если при РН=7 аминокислоты содержат основные функциональные группы.
При закислении (повышении кол-ва Н+), подавляется диссоциация СООН. Т.е. в сильнокислой среде все аминокислоты будут заряжены положительно.
При защелачивании (повышении ОН-), повышается отщепление Н+, что приводит к отрицательному заряду аминокислот.
В состав белков могут входить модифицированные аминокислоты, придающие белкам особые свойства. Модификация происходит в самих белках, после их синтеза.
Качественные реакции на аминокислоты:
1.Нингидриновая реакция (на альфа-аминокислоты). Образуется красный пигмент и альдегид. Интенсивность окрашивания пропорциональна количеству аминокислоты.
2.Реакция Сакагучи- определяет аргинин, за счет содержания в нем гуанидиновых групп.
3.Реакция Фоля- определяет цистеин (SH-группы).
4.Ксантопротеиновая реакция (нитрование)- на определение ароматических групп.
5.Реакция Миллона- определяет тирозин (гидроксогруппы в ароматическом кольце).
Белки:
Классификация белков:
-По форме молекулы.
1.Глобулярные- молекула имеет форму элипса. Большинство белков человека. Большая часть из них, хорошо растворима в воде. (миоглобин и гемоглобины)
2.Фибриллярные белки- имеют вытянутую, нитевидную структуру. (коллагены,эластин,кератин,миозин,фибрин)
-По химическому строению:
1.Простые белки-содержат в составе только аминокислотные остатки.
2.Сложные белки-содержат в составе кроме полипептидной цепи, небелковую часть присоединенную слабыми ковалентными связями.
-Гемопротеины- содержат гем.
-Фосфопротеины-содержат остаток фосфорной кислоты. Фосфорный остаток-протеинкиназа.
-Гликопротеины-содержат углеводные остатки.
-Липопротеины-содержат липиды.
-Металлопротеины-содержат металлы.
-По выполняемым функциям:
-ферменты;
-рецепторные белки;
-регуляторные белки;
-структурные белки;
-транспортные белки;
-защитные белки;
-сократительные белки.
-По семействам:
1.Семейство миоглобина-миоглобин, и все виды гемоглобина.
2.Семейство сериновых протеаз-гидролизуют пептидные связи в белковых субстратах. Трипсин, химотрипсин, эластаза, белки фибринолиза и активации свертывания и т. д.
3.Суперсемейство иммуноглобулинов:
Основным критерием для включения белка в это суперсемейство является доменная организация и достоверная гомология аминокислотных последовательностей и пространственных структур отдельных доменнов.
Также похожи их функции: взаимодействие с чужеродными структурами находящимися в жидкостях организма, или на поверхности его клеток.
-Семейство иммуноглобулинов.
-Семейство Т-клеточных антигенораспознающих рецепторов.
-Белки главного комплекса гистосовместимости 1 и 2 классов. (МНС)
-Семейство адгезивных белков, участвующих в узнавании определенных типов клеток и их межклеточных взаимодействиях.
4.Изофункциональные белки (изобелки)- множественные формы одного белка, обнаруживаемые в организмах одного вида.
Гомологичные белки- белки выполняющие одинаковые функции в организмах разных видов.
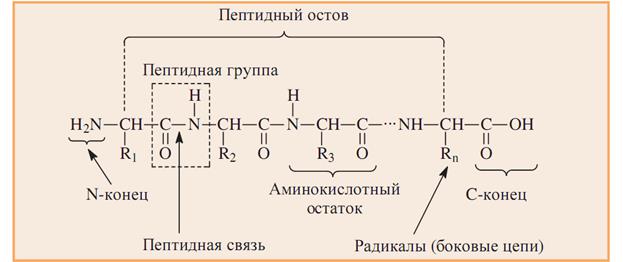
Пептидная связь-это амидная ковалентная связь, соединяющая аминокислоты в полипептидную цепочку (протомер) ( CO-NH) или (О=С-N-Н).
Мономером белковой цепи является аминокислотный остаток. (А.О.)
А.О. Со свободной NH2-группой- это N-концевой остаток (пишется слева).
А.О. Со свободной СООН-группой-это С-концевой остаток (пишется справа).
Последовательность аминокислот в цепи изображают, начиная с N-концевой аминокислоты. С нее же начинается нумерация аминокислотных
остатков.
Строение:
1. До 10 аминокислот в цепи- олигопептиды.
2. Более 10 аминокислотв цепи- полипептиды.
3. Более 50 аминокислот в цепи- белки.
Конформация- распределение полипептидной цепи в пространстве. (уникальность конформации, определяется первичной структурой полипептидной цепи).
Водородная связь-это связь между атомами кислорода СООН и атомами водорода NH2. ( С=О…НN). Водородные связи ориентированы вдоль оси спирали.
Вторичная структура белка образуется путем водородного взаимодействия групп пептидной связи.
Альфа-спираль-NH-группа одного остатка аминокислоты связана водородными связями с СО-группой четвертого от нее остатка.
Почти все атомы Н и О связаны друг с другом, а не с водой.
Радикалы аминокислот находятся с внешней стороны Альфа-спирали и направлены в сторону от пептидных остовов.
Бета- складчатая структура-формируется за счет образования водородных связей между атомами пептидных групп линейных областей одной полипептидной (внутрицепочечная связь) цепи или разных (межцепочечная связь) полипептидных цепей.
Водородные связи в бетта- цепях располагаются перпендикулярно цепи.
Если N и C концы цепей совпадают- паралельные Бета-цепи.
Если не совпадают- антипаралельные.
Бетта-цепи обнаруживаются как в глобулярных, так и в фибриллярных белках.
Беспорядочный клубок-молекула белка, не имеющая правильной упорядоченной организации. (эта конформация определяется первичной структурой белка.)
Нерегулярные вторичные структуры (беспорядочный клубок)- имеющая свою для каждого белка фиксированную конформацию петлеобразная структура с меньшей регулярностью укладки, чем Альфа и Бетта-структуры.
Дата добавления: 2015-06-17; просмотров: 2516;
