ПЕРЕНОС ВЕЩЕСТВА И ХИМИЧЕСКАЯ РЕАКЦИЯ
Любая химическая реакция приводит к тому, что вещество либо расходуется, либо образуется. Поэтому нужно подводить реагенты в зону реакции и отводить из нее образующиеся вещества (продукты). В этом одна из главных функций потока. Если реакция гомогенная, т. е. проходит в объеме текущей жидкости, то, как правило, поток справляется со своей ролью.
Но далеко не все реакции проходят в объеме одной движущейся жидкости (или газа). В технологии чаще встречаются реакции гетерогенные. Гетерогенные реакции имеют несколько вариантов, важнейшие из которых два. Пример первого варианта — поглощение диоксида углерода щелочным раствором. В этом случае реакция проходит в жидкости, в ней. же с самого начала находится один из реагентов (щелочь).. Другой же реагент (СО2) должен прежде чем вступить в реакцию, перейти из газа в жидкость (из одной фазы в другую). При этом молекулы СО2 дважды проходят пограничные слои: в газе у границы с жидкостью и в жидкости у границы с газом. Пограничные слои возникают на границе фаз — именно наличие этой границы и определяет специфику гетерогенного процесса.
Второй вариант гетерогенных процессов не менее важен. Это случай, когда движется только одна фаза (чаще всего газ), а вторая фаза твердая. Но реакция происходит не в объеме газа, а на границе — на поверхности твердого тела. Прежде всего так идут гетерогенно-каталитические реакции, протекающие на поверхности твердого катализатора. Молекулы реагентов, прежде чем вступить в реакцию, должны продиффундировать через пограничный слой у твердой поверхности. Бывают и некаталитические реакции того же типа, например, горение твердого топлива, когда реакция идет на границе топлива с воздухом.
Общая черта гетерогенных реакций заключается в необходимости подвода вещества в зону реакции через пограничный слой. Если рассмотреть путь отдельной молекулы, вступающей в реакцию, то он складывается из ряда последовательных стадий: диффузия к поверхности (или из одной фазы в другую), реакция, затем часто и обратная диффузия продуктов реакции. Мы уже не в первый раз сталкиваемся с такой ситуацией, и поэтому становится ясным, что общая затрата времени на все стадии будет больше, чем на какую-либо одну. Значит, скорость суммарного процесса окажется меньше скорости одной стадии. Говорят: диффузия тормозит химическую реакцию, и все явление в целом называют диффузионным торможением. Ясно должно быть и еще одно. Если одна из стадий много медленнее остальных, она станет лимитировать весь процесс.
Как это происходит, разберем на простом примере необратимой реакции, проходящей на поверхности катализатора. При этом поверхность омывается потоком газа. Одно из современных направлений химии, изучающего скорость химических реакций в условиях, когда на нее влияют процессы переноса тепла и вещества. Это направление называют макрокинетикой.
Итак, вещество А превращается в вещество В по реакции А—>-В. Реакция идет на поверхности катализатора. Скорость реакции ωпропорциональна концентрации сА реагента А:
ω =кСА (7)
Коэффициент пропорциональности к называют константой скорости реакции. По-видимому, в формуле (7) есть все, что нужно для расчета скорости. Но эта видимость обманчива. Концентрация СА, определяющая скорость,— это концентрация у самой поверхности. Обозначим ее сп. Мы не имеем возможности непосредственно измерить эту концентрацию: слишком тонок этот приповерхностный слой, толщина которого порядка размера молекулы. Измерить мы можем лишь концентрацию вещества А в ядре потока ся; но она не равна сп, и задача состоит в том, чтобы их связать.
Рассмотрим решение этой задачи так. В уравнениях (7) и (4). Что такое ω? По определению, скорость гетерогенной реакции — это количество вещества, реагирующее в единицу времени на единице поверхности. А поток gт — количество вещества, подводимое в единицу времени к единице поверхности. Но если реакция подходит стационарно (а это главный случай, наиболее важный для анализа), то
ω = gт (8)
Действительно, если ω>gт, то откуда берется то вещество, которое реагирует, но не подводится к поверхности? А если ω<gт , то куда девается избыток подводимого вещества?
Но из соотношения (8) следует равенство правых частей формул (7) и (4), т. е. ксп=β(ся—сп), откуда сп= βся/(к+ β). Подставляя это выражение в уравнение (7), получим:
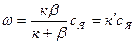 (9)
(9)
Уравнение (9) почти полностью аналогично уравнению (7). Только вместо неизвестной сп здесь известная величина ся, а вместо коэффициента к, отражающего химизм реакции, величина к', которая учитывает как скорость реакции, так и перенос вещества. Легко также получить следующее соотношение: к′= кβ/(к+β) или
к′=1/β+1/к. (10)
Формулу (10) можно понимать так. Левая часть — общее сопротивление переносу, которое складывается из диффузионного сопротивления 1/β и кинетического сопротивления 1/к. Если β>>к (быстрая диффузия, медленная реакция), то из (10) следует: k'≈k ω≈kСя. В этом случае лимитирует кинетика (медленная химическая стадия); говорят, что реакция проходит в кинетической области. Наоборот, если β<<к (реакция много быстрее диффузии), то к′≈ β и ω≈ β Ся , т. е. лимитирует диффузия; реакция проходит в диффузионной области. Наконец, если к ≈ β , то лимитирующей стадии нет, реакция проходит в промежуточной области.
Что это значит практически? Для этого нужно учесть, что сильнее всего влияет на к и на β. Величина к наиболее сильно зависит от температуры. С повышением температуры на 10° обычно наблюдается рост к в 2—3 раза. В то же время к не зависит от состояния потока: турбулентный он или ламинарный, быстрый или медленный, все это на химизм реакции не влияет.
Наоборот, β сильно зависит от скорости потока (чем сильнее выражена турбулентность, тем тоньше пограничный слой) и довольно слабо зависит от температуры. Если движущаяся фаза — газ (так бывает чаще всего), то зависимость (β от температуры почти совсем отсутствует. Поэтому кинетическая область наиболее характерна для низких температур, а диффузионная — для высоких. Повышение скорости газа способствует переходу в кинетическую область. Подробный анализ уравнения (10) показывает, что зависимость ωот температуры Т имеет характер, изображенный на рис. 5. В нижнем левом углу — кинетическая область. При низких температурах скорость реакции мала, но зато быстро растет с ростом температуры. При высоких температурах рост скорости существенно замедляется. Теперь константа скорости реакций велика и продолжает расти, но мы этого не замечаем: лимитирует уже диффузия, которая с ростом температуры почти не ускоряется.
Если мы хотим ускорить процесс, проходящий в кинетической области, нужно прежде всего повысить температуру; если же область диффузионная, то нужно думать о турбулизации потока, повышении его скорости. Примером может служить процесс окисления древесины. Это очень сложный процесс и в действительности не полностью гетерогенный (горение идет не только на поверхности, но и в газовой фазе, куда выделяются продукты сухой перегонки). Но в основном реакция идет все же на поверхности. Этот процесс может проходить в двух основных вариантах. Первый — медленное окисление при сравнительно низких температурах под действием микроорганизмов — гниение. Оно проходит в кинетической области. Второй — быстрый, высокотемпературный — горение, проходящее в диффузионной области..
Проверим, как выведенные нами закономерности соблюдаются в этом случае. Скорость гниения (при достаточной влажности) зависит в первую очередь от температуры: бревно, которое на Земле Франца-Иосифа пролежит почти целым десятки лет, в джунглях Лаоса сгниет за год. В то же время гниение происходит почти с одинаковой скоростью и в штиль, и в шторм. А вот с горением — дело совсем иное. Известно,- что часто, чтобы заставить дрова разгореться, на них дуют. Задумывались ли вы, что это значит с точки зрения химии? Дуем мы воздухом из легких, содержащим не 21 % кислорода, а всего около 16 %. Скорость реакции должна бы уменьшиться! Кроме того, дуя, мы подводим в зону реакции холодный воздух: температура снижается, константа скорости реакции уменьшается. А дрова, казалось бы, вопреки химии, разгораются. Почему? Да потому, то когда мы дуем, мы утончаем пограничный слой и облегчаем диффузию кислорода. Для реакции, идущей в диффузионной области, это оказывается главным.
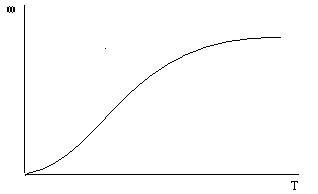
Рис. 4. Зависимость скорости реакции от температуры
Дата добавления: 2015-06-17; просмотров: 1245;
