Диффузионные стадии
В результате протекания гетерогенной химической реакции в разных точках реакционного пространства устанавливаются различные концентрации реагирующих веществ и продуктов реакции. Например, при взаимодействии газообразного реагента А с твердым реагентом В концентрация вещества А у поверхности реагента В будет в общем случае меньше, чем в ядре газового потока, обтекающего твердую частицу.
Градиент концентраций реагента А является причиной возникновения диффузии – самопроизвольного процесса переноса вещества в результате беспорядочного движения молекул до установления равновесного распределения концентраций. Хаотическое тепловое движение частиц вещества вызывает упорядоченный направленный перенос его в области, где возникают градиенты концентрации или где распределение концентраций отличается от равновесного.
При рассмотрении гетерогенных процессов важно знать, какова скорость диффузионных стадий, предшествующих химической реакции, не будут ли диффузионные процессы тормозить химическое взаимодействие.
Скорость диффузии зависит от плотности и вязкости среды, температуры, природы диффундирующих частиц, воздействия внешних сил и т. д. Закономерности диффузионных процессов описываются законами Фика.
Согласно первому закону Фика количество вещества А, перенесенного вследствие диффузии в единицу времени через поверхность S, перпендикулярную направлению переноса, пропорционально градиенту концентрации этого вещества в данный момент времени τ:
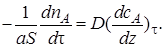 (7.3)
(7.3)
Коэффициент пропорциональности D называется коэффициентом молекулярной диффузии;его единицы измерения (длина)2∙(время)–1, например см2∙с–1.
В общем случае концентрация меняется как в пространстве, так и во времени. Изменение концентрации вещества А во времени в результате молекулярной диффузии описывается вторым законом Фика
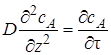
или для диффузии в трехмерном пространстве
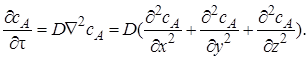
Заменим в уравнении (7.3) градиент концентрации на отношение конечных приращений:

где ∆cА – изменение концентрации на расстоянии ∆z = δ – толщины слоя, через который проходит диффузионный поток. Тогда
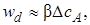
где β – коэффициент пропорциональности (коэффициент массоотдачи),
 (7.4)
(7.4)
При протекании гетерогенного процесса у поверхности раздела фаз происходят расходование исходных реагентов и образование продуктов реакции. Для стационарного протекания процесса необходимо непрерывное пополнение убыли реагентов у реакционной поверхности и удаление от нее образующихся продуктов. Перенос осуществляется вследствие диффузии при наличии перепада концентраций. Чем быстрее идет реакция, тем выше должна быть и скорость диффузии, иначе химическая реакция будет тормозиться диффузионными процессами.
Можно считать, что перепад концентраций возникает в диффузионном подслое, находящемся у поверхности раздела фаз. Внутри этого диффузионного подслоя перенос вещества осуществляется исключительно вследствие молекулярной диффузии. Чем меньше толщина подслоя δ, тем больше в соответствии с уравнением (7.4) коэффициент массоотдачи.
Коэффициент молекулярной диффузии D (коэффициент пропорциональности в уравнениях скорости диффузии) является функцией молекулярных свойств того вещества, которое диффундирует, и того вещества, в котором происходит диффузия первого. Он слабо возрастает с ростом температуры (~Т – Т3/2) и уменьшается с ростом давления. Чаще всего коэффициент D определяют по опытным данным, а также по эмпирическим или полуэмпирическим зависимостям.
§ 7.3. Гетерогенные некаталитические процессы
в системе «газ – твердое вещество»
Гетерогенные процессы в системе «газ – твердое вещество» – распространенный вид промышленных химико-технологических процессов. Это процессы обжига различных руд, получения цементного клинкера, поглощения сероводорода оксидом цинка и др. Даже внутри этой группы можно различить определенные разновидности гетерогенных процессов. Наиболее общим случаем является гетерогенная реакция, в которой и среди реагентов, и среди продуктов есть и газообразные, и твердые вещества:
аА + bВ  rR + sS.
rR + sS.
газ твердое газ твердое
вещ-во вещ-во
К такому типу реакций относится, например, процесс обжига железного (серного) колчедана:
11О2 + 4FeS2  8SO2 + 2Fe2O3.
8SO2 + 2Fe2O3.
Возможны также реакции, в которых отсутствует или газообразный реагент, или твердый продукт и т. п.
Например:
аА + bВ  rR.
rR.
газ твердое газ
вещ-во
Кинетические модели гетерогенных процессов в системе «газ – твердое вещество».Существует ряд кинетических моделей, несколько упрощающих природу гетерогенных процессов, но позволяющих описать их с помощью сравнительно простых уравнений. Наиболее распространенными среди них являются модель с фронтальным перемещением зоны реакции (модель с непрореагировавшим ядром) и квазигомогенная модель. Рассмотрим, в чем отличие этих моделей на примере гетерогенной реакции
аА + bВ  rR + sS,
rR + sS,
гaз твердое газ твердое
вещ-во вещ-во
при протекании, которой внешние размеры твердой частицы не меняются.
Квазигомогенная модель предполагает, что гетерогенный процесс протекает одновременно в любой точке объема твердой частицы. Это возможно, если газообразный реагент может достаточно свободно проникнуть внутрь твердой фазы, т. е. если частица твердого вещества пронизана большим числом пор, а химическая реакция, протекающая на поверхности этих пор, достаточно медленная.
На рис. 7.1 показано, как изменяется по объему твердой фазы в разные моменты времени от начала реакции концентрация твердого реагента В, если гетерогенный процесс протекает в соответствии с квазигомогенной моделью.
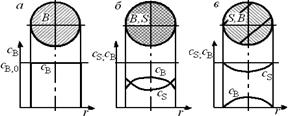
Рис. 7.1. Схематическое изображение твердой частицы
в ходе гетерогенного процесса, описываемого квазигомогенной моделью:
а – до реакции; б – в промежуточный момент реакции;
в – почти полностью превращенная частица
Более распространенной является модель с фронтальным перемещением зоны реакции. Согласно этой модели химическая реакция сначала протекает на внешней поверхности частицы, и до тех пор, пока внешний слой твердого реагента полностью не превратится в соответствующие твердые или газообразные продукты реакции, более глубинные слои в реакцию не вступают. Постепенно зона химической реакции продвигается внутрь, оставляя за собой твердый продукт реакции и инертную часть исходного твердого реагента (золу). В произвольный момент времени твердая частица представляет собой внутреннее ядро, окруженное внешней оболочкой. Ядро состоит из непрореагировавшего реагента (поэтому эту модель называют иногда моделью с непрореагировавшим ядром). Окружающая его оболочка состоит из твердого продукта и инертных веществ. Развитие гетерогенного процесса по этой модели показано на рис. 7.2.
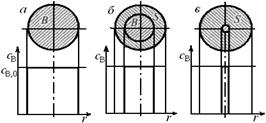
Рис. 7.2. Профиль изменения концентрации твердого реагента В по мере
протекания гетерогенного процесса, описываемого моделью с фронтальным перемещением зоны реакции: а – до реакции; б – в промежуточный момент реакции; в – почти полностью превращенная частица
Рассмотрим более детально особенности гетерогенного процесса, описываемого моделью с фронтальным перемещением зоны реакции. Объектом рассмотрения будет одиночная твердая частица с неизменяющимися во времени внешними размерами, обтекаемая потоком газообразного реагента А. Об отдельных этапах процесса будем судить по концентрации реагента А в разных точках пространства (рис. 7.3).
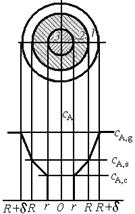
Рис. 7.3. Профиль изменения концентрации газообразного реагента при взаимодействии с твердой частицей (модель с фронтальным перемещением зоны реакции): 1 – пограничная газовая пленка с концентрацией реагента А ниже, чем в газовом потоке; 2 – слой твердых продуктов реакции (слой золы); 3 – ядро непрореагировавшего реагента В
Гетерогенный процесс, описываемый моделью с фронтальным перемещением зоны реакции, можно разделить на пять основных стадий:
1.Внешняя диффузия – подвод реагента А к поверхности твердой частицы через слой газа, обедненный этим компонентом.
2.Внутренняя диффузия – проникновение газообразного реагента через поры твердого продукта реакции к ядру твердого реагента.
3.Химическая реакция на поверхности непрореагировавшего ядра.
4.Внутренняя диффузия газообразных продуктов через слой твердых продуктов.
5.Внешняя диффузия газообразных продуктов в ядро газового потока.
Стадии 4 и 5 в ряде случаев из рассмотрения можно исключить, в частности, тогда, когда протекающая химическая реакция является необратимой.
Основные стадии процесса, описываемого моделью с фронтальным перемещением зоны реакции. Рассмотрим стадии внешней и внутренней диффузии, поверхностной химической реакции.
Внешняя диффузия. В результате протекания химической реакции
aА + bВ  Продукты
Продукты
газ твердое
вещ-во
концентрация газообразного реагента А у поверхности твердой частицы ниже, чем в ядре газового потока. Нельзя точно установить пространственное расположение границы, на которой начинается снижение концентрации газообразного реагента, так как при постоянном обтекании частицы газообразным потоком могут происходить колебания этой границы. Однако условно можно принять, что граница проходит на некотором расстоянии δ от поверхности твердой частицы. Тогда можно условно зафиксировать поверхностную газовую пленку толщиной δ, характеризующуюся тем, что за ее пределами концентрация газообразного реагента постоянна и равна cA,g (индекс «g» – gas), а внутри пленки сА уменьшается от сА,g до концентрации на поверхности твердой частицы cA,s (индекс «s» – от англ. surface – поверхность).
Вещество А переносится из ядра газового потока к поверхности частицы через пограничную газовую пленку как вследствие молекулярной диффузии, механизм которой рассмотрен выше, так и вследствие движения с газовой средой в направлении, совпадающем с направлением потока, т. е. вследствие конвективного переноса. Суммарный перенос вещества вследствие молекулярной диффузии и конвективного переноса называется конвективной диффузией.
Процесс конвективной диффузии может быть описан дифференциальным уравнением
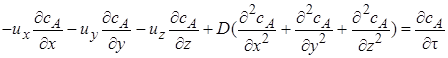
или в более краткой записи:
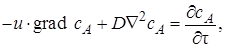
где их, иу, иz – линейные скорости потока в направлении осей соответственно х, у, z.
Так как в этом уравнении переменными величинами являются и концентрация газообразного реагента, и линейная скорость потока, то решать его нужно совместно с дифференциальными уравнениями гидродинамики. В результате получается система дифференциальных уравнений, не имеющая аналитического решения.
Обычно для определения скорости конвективной диффузии пользуются уравнением
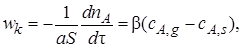 (7.5)
(7.5)
где wk – скорость конвективной диффузии, т. е. количество газообразного реагента А, перенесенное вследствие конвективной диффузии через единицу поверхности в единицу времени; β – коэффициент массоотдачи, зависящий от гидродинамики потока.
Принимают, что у поверхности твердой частицы существует неподвижный диффузионный подслой толщиной δ1, внутри которого перенос вещества осуществляется исключительно вследствие молекулярной диффузии. Скорость внешней диффузии (конвективной) через реальную газовую пленку толщиной δ можно приравнять тогда скорости молекулярной диффузии через диффузионный подслой толщиной δ1. В соответствии с уравнением (7.4)
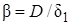 ,
,
где D – коэффициент молекулярной диффузии.
Повысить скорость внешней диффузии можно, увеличивая движущую силу, которая равна разности концентраций cA,g и cA,s, либо коэффициент массоотдачи.
Для увеличения β нужно: если это, возможно, повысить коэффициент молекулярной диффузии D;уменьшить толщину газовой пленки δ1.
Как было показано выше, коэффициент молекулярной диффузии определяется в основном молекулярной природой веществ, участвующих в процессе диффузии, а также слабо зависит от температуры и давления.
Так, например, коэффициент молекулярной диффузии реагентов в газовую пленку при росте температуры с 700 до 800 К увеличивается лишь в (800/700)1,5 = 1,22 раза. Таким образом, рост температуры проведения процесса не может служить надежным способом интенсификации диффузии.
Значительно больший эффект может быть достигнут при уменьшении толщины пленки δ1. Хотя в рамках принятой модели нельзя точно сказать, чему численно равна δ1, можно с уверенностью утверждать, что все способы уменьшения толщины пленки приведут к увеличению коэффициента массоотдачи. Такими способами являются: увеличение линейной скорости газового потока, обтекающего твердую частицу, приводящее к срыванию пленки; проведение процесса при интенсивном перемешивании частиц твердой фазы, например применение аппаратов с псевдоожиженным слоем твердой фазы.
Внутренняя диффузия. Если в результате гетерогенного взаимодействия газообразного и твердого реагентов наряду с газообразными образуются и твердые продукты реакции, стадией, предшествующей собственно химической реакции и следующей за внешней диффузией, будет стадия внутренней диффузии – проникновения газообразного реагента через слой твердых продуктов реакции к поверхности ядра, на которой осуществляется химическое взаимодействие.
Скорость внутренней диффузии

где Dэф – эффективный коэффициент диффузии, учитывающий пористость твердого вещества, извилистость пор и т. д.
Так как слой твердых продуктов реакции представляет собой определенное сопротивление переносу реагента А из пограничной газовой пленки к поверхности ядра, то концентрация этого реагента по мере движения к поверхности ядра будет уменьшаться от cA,s на внешней поверхности твердой частицы до сА,с (индекс «с» от англ. core – ядро) на поверхности ядра (см. рис. 7.3).
Если толщина слоя золы невелика, можно условно считать, что

где R – внешний радиус твердой частицы – постоянная величина в рамках рассматриваемого случая частицы с не изменяющимися внешними размерами; r – радиус ядра, уменьшающийся по мере протекания процесса.
Тогда скорость внутренней диффузии можно представить в виде уравнения
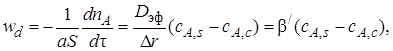 (7.6)
(7.6)
т. е. по своей структуре уравнение скорости внутренней диффузии аналогично уравнению скорости внешней диффузии: произведение разности концентраций на коэффициент массоотдачи 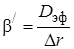 . Повысить скорость внутреннедиффузионной стадии возможно в основном увеличением коэффициента массоотдачи β/. Существенно повысить коэффициент диффузии, как это было показано, достаточно сложно. Следовательно, нужно идти по пути уменьшения толщины слоя твердых продуктов реакции, равной R – r. Максимальная толщина этого слоя равна R (при r = 0) – внешнему радиусу твердой частицы. Уменьшение размеров твердой частицы (измельчение) автоматически приводит и к уменьшению толщины слоя твердых продуктов, т. е. к увеличению коэффициента массоотдачи β/. Таким образом, измельчение твердых частиц – основной путь интенсификации внутренней диффузии.
. Повысить скорость внутреннедиффузионной стадии возможно в основном увеличением коэффициента массоотдачи β/. Существенно повысить коэффициент диффузии, как это было показано, достаточно сложно. Следовательно, нужно идти по пути уменьшения толщины слоя твердых продуктов реакции, равной R – r. Максимальная толщина этого слоя равна R (при r = 0) – внешнему радиусу твердой частицы. Уменьшение размеров твердой частицы (измельчение) автоматически приводит и к уменьшению толщины слоя твердых продуктов, т. е. к увеличению коэффициента массоотдачи β/. Таким образом, измельчение твердых частиц – основной путь интенсификации внутренней диффузии.
Поверхностная химическая реакция. Главной стадией гетерогенного химического процесса является поверхностная реакция, в результате которой и происходят все те изменения, которые составляют природу гетерогенного процесса.
Если химическая реакция необратима (а это распространенный класс химических реакций, например реакции горения твердых тел), концентрация газообразного реагента на поверхности ядра уменьшится от концентрации сА,с, достигнутой после стадии внутренней диффузии, до нуля, т. е. до его полного расходования.
Скорость поверхностной реакции может быть описана законами химической кинетики
 (7.7)
(7.7)
где ks – константа скорости поверхностной химической реакции; п – порядок реакции.
При проведении количественных расчетов следует иметь в виду, что так как скорость поверхностной реакции измеряется количеством вещества, расходуемого в единицу времени на единице реакционной поверхности, например кмоль/(м2∙ч), то это отразится на единицах измерения константы скорости ks
[ks] = [wr] / [сА,c].
Например, для реакции первого порядка
[ks]= [кмоль(м2∙ч)]/(кмоль/м3) = м/ч
в отличие от единиц константы скорости реакции, протекающей в объеме ([k]= ч–1).
Скорость химической стадии может быть, как и в случае предыдущих стадий, увеличена либо вследствие возрастания концентрации газообразного реагента сА,с (для этого нужно, очевидно, увеличивать концентрацию cA,gв потоке, обтекающем частицу), либо же главным образом вследствие роста константы скорости химической реакции ks. Так как в соответствии с уравнением Аррениуса константа скорости химической реакции с ростом температуры увеличивается по экспоненциальной зависимости, то основной путь интенсификации гетерогенного процесса, протекающего в кинетической области, – повышение температуры.
Константа скорости гетерогенного процесса. Лимитирующая стадия. Уравнения (7.5), (7.6) и (7.7) позволяют рассчитать скорости отдельных стадий гетерогенного процесса. Однако эти стадии протекают не изолированно, а во взаимодействии друг с другом. Поэтому для расчета скорости гетерогенного процесса нужно иметь уравнение, которое учитывает особенности всех стадий.
Было бы удобно выразить скорость гетерогенного процесса, по аналогии с законом действующих масс, как произведение некоторой константы скорости К на концентрацию газообразного реагента в газовом потоке cA,g:
wa = kcA,g.
Это оказывается вполне выполнимым для стационарных условий проведения гетерогенного процесса, включающего в себя реакцию первого порядка. При этом используется условие (7.1) о равенстве скоростей последовательных стадий в стационарном режиме.
Выпишем уравнения скоростей отдельных стадий:
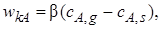 (7.8)
(7.8)
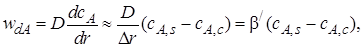 (7.9)
(7.9)
 7.10)
7.10)
Представим уравнения (7.8)–(7.10) таким образом, чтобы в их правых частях остались только концентрации реагентов, а затем почленно сложим их с учетом того, что в стационарных условиях wrA = wdA = wkA = wA:
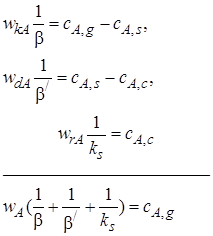
Получаем
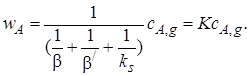 (7.11)
(7.11)
Tаким образом, скорость гетерогенного процесса представлена в виде произведения константы скорости гетерогенного процесса К на концентрацию реагента А в газовой фазе cA,g.
Проанализируем структуру константы скорости гетерогенного процесса К. В знаменателе дроби стоит сумма величин, обратных коэффициентам интенсивности отдельных стадий. По аналогии с коэффициентом теплопередачи в теории теплопереноса эту сумму можно рассматривать как сумму сопротивлений на отдельных стадиях гетерогенного процесса.
Возможны ситуации, когда сопротивление одной из стадий существенно превышает сопротивление двух других стадий, т. е. одна стадия затруднена по сравнению с другими. Тогда константа скорости гетерогенного процесса с достаточно хорошим приближением будет равна коэффициенту интенсивности данной стадии.
Например, если 1/β>>1/β/ и 1/β>>1/ks, то К≈β, а wA=KcA,g=βсА,g, (7.12)
т. е. скорость процесса определяется скоростью конвективной диффузии газообразного реагента А через пограничную газовую пленку. Уравнение (7.12)может быть получено из уравнения скорости конвективной диффузии (7.8) при cA,s = 0. Действительно, если сопротивление со стороны внешней диффузии существенно превышает сопротивление со стороны внутренней диффузии, а поверхностная химическая реакция протекает с высокой скоростью, то практически наблюдаемая концентрация cA,s реагента А на поверхности твердой частицы будет равна нулю, так как все молекулы реагента А, преодолев значительное внешнедиффузионное сопротивление и далее уже не встречая сопротивления, пройдут через слой твердых продуктов и практически мгновенно вступят в реакцию. Таким образом, на этой стадии происходит максимальное изменение концентрации газообразного реагента.
Если такая затрудненная стадия существует, ее называют лимитирующей. Лимитирующая стадия определяет скорость гетерогенного процесса в целом, поэтому ее называют также скорость определяющей стадией.
Расчетные зависимости времени протекания гетерогенной реакции от степени превращения твердого реагента.Рассмотрим взаимодействие одиночной твердой частицы реагента В с обтекающим ее потоком газообразного реагента А по реакции
аА + bВ → rR + sS.
газ твердое газ твердое
вещ-во вещ-во
Примем, что твердая частица имеет сферическую форму и во время протекания гетерогенного процесса внешние размеры частицы не меняются. Пусть радиус частицы равен R,радиус ядра – r.
Для установления зависимости между хВ иτ необходимо знать, какова скорость процесса и какими факторами она определяется. Если гетерогенный процесс лимитируется одной из последовательных стадий, то скорость всего процесса равна скорости этой стадии. Тогда вывод зависимости хB(τ) существенно упрощается.
Рассмотрим случаи лимитирования процесса со стороны внешней диффузии, внутренней диффузии и химической реакции.
Процесс лимитируется внешней диффузией. Основное сопротивление сосредоточено на стадии проникновения газообразного реагента А через пограничную газовую пленку, обедненную этим реагентом. Скорость гетерогенного процесса, равная в этом случае скорости конвективной диффузии, определяется уравнением
 (7.13)
(7.13)
На рис. 7.4, а приведен профиль изменения концентрации газообразного реагента, отвечающий протеканию процесса во внешнедиффузионной области. Так как при этом стадии, следующие за диффузией реагента А через пограничную газовую пленку, не оказывают сопротивления дальнейшему проникновению А через слой твердых продуктов реакции и взаимодействию с ядром реагента В, то можно принять, что концентрация cA,s реагента А на поверхности твердой частицы равна нулю.
Рис. 7.4. Профиль изменения концентрации газообразного реагента
при лимитировании гетерогенного процесса внешней (а), внутренней (б)
диффузиями и химической реакцией (в)
С учетом этого уравнение (7.13) упрощается:
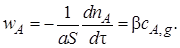
Скорость гетерогенной реакции можно выразить через изменение во времени количеств газообразного реагента А и твердого реагента В:
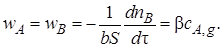 (7.14)
(7.14)
Количество реагента В в твердой частице можно представить как произведение объема ядра VB на молярно-объемную плотность ρB (это, по сути, молярная концентрация реагента В в кмоль/м3); пB = VB ρB. Так как твердая частица имеет сферическую форму, то VB = (4/3)πr3. Тогда
 (7.15)
(7.15)
Поверхность S,к которой отнесена скорость внешней диффузии,– это внешняя поверхность твердой частицы с радиусом R:
S = 4nR2. (7.16)
Подставляя dnB из уравнения (7.15) и S из уравнения (7.16) в уравнение (7.14), получим
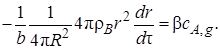 (7.17)
(7.17)
Решим дифференциальное уравнение (7.17) при начальном условии r = R,если τ= 0:

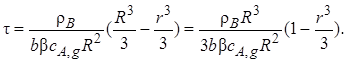
Отношение r3/R3можно заменить на отношение объема ядра к объему всей твердой частицы (VB/V0 = r3/R3) и, умножив числитель и знаменатель на рB, получим
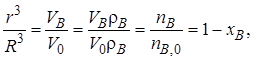 (7.18)
(7.18)
где V0 – полный объем твердой частицы неменяющихся размеров.
С учетом формулы (7.18)
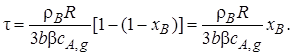 (7.19)
(7.19)
При хB = 1 (весь реагент В прореагировал) уравнение (7.19) позволит определить время полного превращения твердой частицы τn, если гетерогенный процесс лимитируется внешней диффузией:
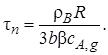 (7.20)
(7.20)
Следовательно, для внешнедиффузионной области протекания гетерогенного процесса зависимость между τ и хB имеет линейный характер:
 (7.21)
(7.21)
При проведении гетерогенной реакции в промышленном реакторе можно условно рассматривать каждую твердую частицу как самостоятельный микрореактор. Для увеличения производительности реактора нужно стремиться к уменьшению времени полного превращения твердой частицы τn. При протекании гетерогенного процесса во внешнедиффузионной области это возможно при уменьшении радиуса частицы и повышении концентрации газообразного реагента cA,g, а также увеличении коэффициента массоотдачи. Последнее возможно, как это указывалось выше, при возрастании линейной скорости газа и турбулизации потока.
Процесс лимитируется внутренней диффузией. Если гетерогенный процесс лимитируется внутренней диффузией, то на этой стадии сосредоточено основное сопротивление и, как следствие, концентрация газообразного реагента меняется от сА,gдо нуля на пространстве от внешней оболочки частицы до ядра (см. рис. 7.4, б).
Скорость гетерогенного процесса в этом случае может быть приравнена к скорости диффузии через пористый слой твердых продуктов:
 (7.22)
(7.22)
Поверхность S,к которой отнесена скорость гетерогенного процесса при лимитировании его внутренней диффузией, – это поверхность ядра с радиусом r при сферической форме частицы:
S = 4πr2. (7.23)
Исходя из физических соображений, можно несколько упростить математический аппарат решения уравнения (7.22), приняв допущение о квазистационарности условий диффузии вещества А по отношению к перемещению границы ядра реагента В к центру частицы.
Одновременно с диффузией реагента А от периферии частицы к поверхности непрореагировавшего ядра происходит и перемещение границы ядра к центру частицы.
Примем на первом этапе интегрирования, что скорость изменения размеров ядра (она определяется производной dnB/dτ= ρB dVB/dτ) постоянна (квазистационарна) по отношению к скорости диффузии газа, определяемой градиентом концентрации dcA/dr. Тогда уравнение (7.22) с учетом уравнения (7.23) можно записать так:
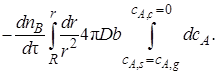
Откуда
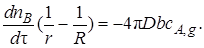 (7.24)
(7.24)
На втором этапе интегрирования будем считать, что размеры ядра меняются. Так как в соответствии с уравнением (7.15) dnB = 4πr2ρBdr,то уравнение (7.24) примет вид
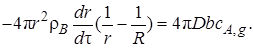 (7.25)
(7.25)
Проинтегрируем уравнение (7.25) по времени от τ = 0 (когда размер ядра равен размеру частицы, т. е. r = R)до текущего времени τ, при котором непрореагировавшее ядро имеет радиус r:
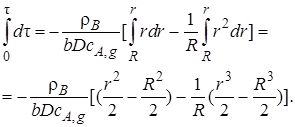 (7.26)
(7.26)
Если дроби в квадратных скобках уравнения (7.26) привести к общему знаменателю и вынести за скобки R3,получим
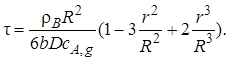
С учетом соотношения (7.18)
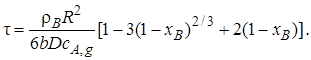 (7.27)
(7.27)
При хВ = 1 уравнение (7.27) позволит рассчитать время полного превращения твердой частицы τn при протекании гетерогенного процесса во внутреннедиффузионной области:
 (7.28)
(7.28)
Итак, для внутренне диффузионной области некаталитического гетерогенного процесса
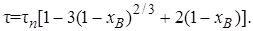 (7.29)
(7.29)
Уравнение (7.28) можно записать и в таком виде:
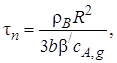 (7.30)
(7.30)
где β/ – коэффициент массоотдачи на стадии внутренней диффузии;
 (7.31)
(7.31)
(принято, что средняя толщина слоя продуктов реакции равна половине внешнего радиуса частицы).
В таком виде уравнение (7.30) для определения времени полного превращения твердой частицы при протекании гетерогенного процесса во внутреннедиффузионной области аналогично уравнению (7.20), выведенному для внешнедиффузионной области.
Основной путь интенсификации гетерогенного процесса, протекающего во внутреннедиффузионной области, – увеличение коэффициента массоотдачи β/. Этот коэффициент тем выше, чем больше коэффициент диффузии D и чем меньше толщина слоя продуктов реакции ∆r. Коэффициент диффузии D слабо зависит от температуры и определяется характером пористой структуры (пористостью и коэффициентом извилистости пор). Легче повлиять на величину ∆r. Из уравнения (7.31) видно, что толщину слоя можно принять равной половине первоначального радиуса твердой частицы. Чем меньше размер частиц, тем меньше ∆r и тем больше коэффициент β/. Следовательно, чтобы уменьшить сопротивление внутренней диффузии, нужно измельчить твердый материал.
Процесс лимитируется химической реакцией. Если стадии внешней и внутренней диффузии не оказывают сопротивления процессу (отсутствует диффузионное торможение), то на химическую реакцию не накладывается никаких дополнительных ограничений и скорость всего гетерогенного процесса зависит только от чисто кинетических факторов. С учетом того, что при лимитировании химической реакцией сА,с = cA,s = cA,g (см. рис. 7.4, в),

В частности, для поверхностной химической реакции первого порядка
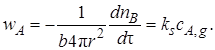 (7.32)
(7.32)
Заменив, как и в предыдущих случаях, в уравнении (7.32)скорость расходования реагента dnB/dτ на скорость продвижения границы ядра dr/dτ, получаем
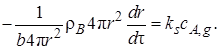
Откуда
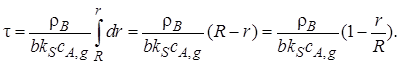 (7.33)
(7.33)
С учетом зависимости (7.18)уравнение (7.33)примет вид
 . (7.34)
. (7.34)
При хВ = 1 из уравнения (7.34)получим время полного превращения τn твердой частицы, имеющей радиус R,при протекании гетерогенного процесса в кинетической области:
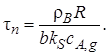
Итак, для кинетической области гетерогенного взаимодействия
 (7.35)
(7.35)
Величина τn в значительной степени определяет производительность и интенсивность реактора для проведения гетерогенного процесса и зависит от значений R и сА,g,входящих также и в уравнения (7.20) и (7.30)расчета времени полного превращения твердых частиц при протекании процесса в диффузионных областях. Зависит она также и от константы скорости поверхностной химической реакции ks. Увеличение ks приведет к резкому росту интенсивности процесса, протекающего в кинетической области. Так как ks зависит в основном от температуры, то наиболее целесообразным способом управления гетерогенным процессом, лимитируемым химической реакцией, является именно изменение температуры.
Способы определения лимитирующей стадии.Расчет реакторов для проведения гетерогенных процессов в системе «газ – твердое вещество» удобно вести, если известна лимитирующая стадия процесса, так как в этом случае зависимость между временем пребывания частицы в реакторе и степенью превращения твердого реагента выражается однозначными уравнениями (7.21), (7.29) или (7.35). Ясны и способы управления таким процессом. Поэтому важно определить лимитирующую стадию гетерогенного процесса.
Если известны коэффициенты массоотдачи β иβ' и константа скорости ks,то, сравнивая их числовые значения, можно определить, есть ли в данных условиях проведения гетерогенного процесса лимитирующая стадия, и если она есть, то какая именно. Лимитирующая стадия, как указывалось, обладает максимальным сопротивлением. Например, если лимитирует внешняя диффузия,
1/β >> 1/β' и 1/β >> 1/ks
или
β << β' и β << ks.
Если же коэффициенты интенсивности разных стадий – величины одного порядка, то лимитирующей стадии нет, и тогда говорят, что гетерогенный процесс протекает в переходной области.
Однако чаще всего точные значения коэффициентов β, β' и ks неизвестны, расчетные формулы, позволяющие их определить, отсутствуют или справедливы лишь для узкого интервала изменения параметров процесса. В связи с этим наиболее пригодны экспериментальные методы определения лимитирующей стадии. Эти методы можно условно разбить на две группы.
Методы, основанные на изучении влияния параметров гетерогенного процесса на его скорость. Лимитирующую стадию можно экспериментально определить, изучая зависимость скорости гетерогенного процесса от температуры Т,линейной скорости газового потока и и степени измельчения 1/R.
Если гетерогенный процесс в некотором диапазоне изменения параметров его проведения (Т, и,размеры частиц) лимитируется химической реакцией, то скорость его определяется в основном константой скорости поверхностного химического взаимодействия. Константа скорости k экспоненциально увеличивается с ростом температуры, в то время как коэффициенты массоотдачи на диффузионных стадиях β и β' зависят от температуры лишь очень слабо (~T1/2).
Следовательно, если при постоянстве линейной скорости потока и и размера частиц R с увеличением температуры наблюдается резкий рост скорости процесса, то он протекает в кинетической области.
Кинетическая область характерна для сравнительно низких температур проведения процесса. Если рассмотреть зависимость от температуры скорости гетерогенного процесса в широком (несколько сотен градусов) интервале температур (рис. 7.5), можно выделить три характерных участка:
1) участок сильной зависимости от температуры, характер которой приближается к экспоненциальной. Очевидно, что в этом температурном интервале процесс лимитируется химической реакцией (кинетическая область);
2) участок очень слабой зависимости от температуры. Процесс лимитируется либо внешней, либо внутренней диффузией (диффузионная область);
3) переходный участок между кинетической и диффузионной областями, характеризующийся соизмеримым сопротивлением со стороны всех стадий (переходная область).
Если при изучении влияния температуры на скорость гетерогенного процесса окажется, что интересующий нас температурный интервал совпадает с диффузионной областью, нужно решить, какая диффузионная стадия (внешняя или внутренняя диффузия) является лимитирующей.
Скорость конвективной диффузии (внешней) очень сильно зависит от гидродинамической обстановки. Следовательно, увеличение линейной скорости газового потока относительно твердых частиц при неизменных R и T приведет к резкому возрастанию скорости процесса, если он лимитируется внешней диффузией. На рис. 7.5 показана зависимость скорости гетерогенного процесса от температуры при различных значениях линейной скорости и.
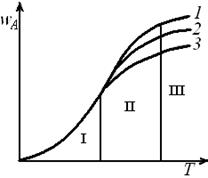
Рис. 7.5. Зависимость скорости гетерогенного процесса от температуры
при постоянном размере твердых частиц R и различных постоянных
значениях линейной скорости газа и: 1 – u1; 2 – и2; 3 – и3(u1 > u2 > u3);
I – кинетическая область; II – переходная область; III – диффузионная область
Скорость внутренней диффузии должна резко увеличиться в случае измельчения твердой фазы (так как β/ = D/(R/2)).Если изучение влияния температуры и линейной скорости потока не позволило определить лимитирующую стадию, а измельчение твердого материала вызвало существенный рост скорости гетерогенного процесса, то это значит, что он лимитируется диффузией в поры твердого вещества (протекает во внутреннедиффузионной области).
Методы, основанные на сравнении экспериментальных и теоретических зависимостей хB(τ). Эта группа методов основана на сравнении экспериментально полученной кинетической зависимости степени превращения твердого реагента от времени пребывания в реакторе хB(∆τ) и теоретических зависимостей хB(∆τ) для разных областей протекания гетерогенного процесса.
Теоретические зависимости хB(τ) меют вид: для внешнедиффузионной области в соответствии с уравнением (7.21)
 (7.36)
(7.36)
для кинетической области в соответствии с уравнением (7.35)
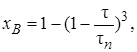 (7.37)
(7.37)
а для внутренне диффузионной области в соответствии с уравнением (7.29) зависимость хB(τ) определяется функцией, заданной в неявном виде:
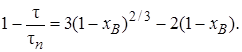 (7.38)
(7.38)
Штриховая, сплошная и штрихпунктирные линии (рис. 7.6) отвечают уравнениям (7.36)–(7.38) соответственно. К сожалению, разница в положениях сплошной и штрихпунктирной линий, соответствующих внутреннедиффузионной и кинетической областям, мала и сопоставима с ошибками эксперимента.
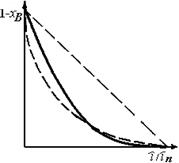
Рис. 7.6. Зависимость доли превращенного твердого реагента от времени
пребывания твердой частицы в реакторе при лимитировании процесса
внешней диффузией (штриховая линия), поверхностной химической
реакцией (сплошная); внутренней диффузией (штрихпунктирная)
Еще один метод обработки экспериментальных зависимостей хB(τ) и сопоставления их с теоретическими уравнениями (7.21), (7.29) и (7.35) состоит в том, что на основе опытных данных о величинах хB в разные моменты времени τ рассчитывают время полного превращения твердой частицы по уравнениям:

(в предположении, что лимитирует внешняя диффузия);
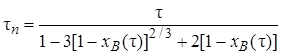
(в предположении, что лимитирует внутренняя диффузия);
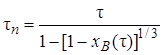
(в предположении, что лимитирует химическая реакция).
По своему физическому смыслу для данных условий осуществления гетерогенного процесса τn – константа, не зависящая от действительного времени пребывания частиц в реакторе.
Поэтому, если лимитирующая стадия существует, то обработка экспериментальных данных по одному из вышеприведенных уравнений должна показать, что τn остается постоянным при любых τ.
§ 7.4. Гетерогенные процессы в системе «газ – жидкость»
Газожидкостные реакции – гетерогенные процессы, включающие в себя химическое взаимодействие между реагентами, один из которых находится в газовой фазе, а другой – в жидкой. Жидкость может представлять собой раствор вещества, химически взаимодействующего с газообразным реагентом; в ряде случаев происходит взаимодействие растворяющегося газа с самим растворителем.
Газожидкостные реакции широко используют в химической технологии. Примеры их применения как самостоятельных процессов получения необходимых продуктов: абсорбция аммиака растворами азотной кислоты при производстве аммиачной селитры или растворами серной кислоты при производстве сульфата аммония (производство удобрений); хлорирование жидких ароматических углеводородов (органический синтез). Примеры их применения в качестве вспомогательных процессов очистки газовых смесей: абсорбция диоксида углерода СО2 водными растворами моноэтаноламина или карбоната калия для очистки синтеза газа в производстве аммиака; абсорбция диоксида серы SO2 растворами сульфита и гидросульфита аммония при санитарной очистке газов.
Газожидкостные реакции принято рассматривать как процессы абсорбции, сопровождающиеся химическим взаимодействием. Такой подход позволяет применить к этой группе химических процессов закономерности массопередачи. При этом считают, что протекание химической реакции на границе раздела газовой и жидкой фаз или в глубине жидкой фазы приводит к ускорению процесса абсорбции.
Возможность таким образом ускорить процесс массопередачи широко используется в практике. Добавляя к растворителю реагенты, вступающие в быстрые химические реакции с компонентами, извлекаемыми из газовой фазы, удается существенно интенсифицировать процесс абсорбции. Например, диоксид углерода СО2 можно извлечь из газовой смеси абсорбцией водой под давлением. Применение вместо воды растворов этаноламинов или карбонатов, вступающих в химическое взаимодействие с СО2, позволяет во много раз повысить интенсивность абсорбции.
Массопередача между газом и жидкостью. Растворимость газа в жидкости во многих случаях, когда концентрация растворенного газа невелика, а температура и давление далеки от критических, подчиняется закону Генри, согласно которому равновесное парциальное давление растворенного газа ρА,e над раствором прямо пропорционально его концентрации в жидкой фазе cA,L:
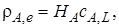 (7.39)
(7.39)
где коэффициент пропорциональности НА называется константой Генри, или константой фазового равновесия.
Скорость массоотдачи от газа к жидкости пропорциональна движущей силе – разности парциальных давлений компонента А в ядре газового потока ρА и на границе раздела фаз ρА,b (см. рис. 7.7):
 (7.40)
(7.40)
где βg – коэффициент массоотдачи со стороны газовой фазы.
В свою очередь скорость массоотдачи от жидкости к газу
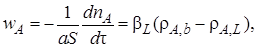 (7.41)
(7.41)
где βL – коэффициент массоотдачи со стороны жидкой фазы; сА,b – концентрация растворенного реагента А на границе раздела фаз; cA,L – концентрация растворенного компонента А в основной массе жидкой фазы.

Рис. 7.7. Распределение парциального давления и концентрации
растворяемого газообразного вещества А в фазах при массопередаче
Обычно при расчете процессов массопередачи принимают, что на границе раздела фаз достигается равновесие. Это предположение равносильно допущению о том, что сопротивлением переносу через границу раздела фаз можно пренебречь, а все сопротивление массопередачи сосредоточено, с одной стороны, в слое газа, примыкающем к поверхности раздела фаз, с другой – в граничащем с ним слое жидкости.
При равновесии в соответствии с законом распределения [см. формулу (7.39)]
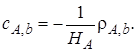 (7.42)
(7.42)
Для вывода уравнения скорости массопередачи, учитывающего сопротивление со стороны жидкой и газовой фаз, запишем уравнения (7.40)и (7.41)в следующем виде:
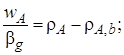 (7.43)
(7.43)
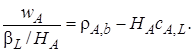 (7.44)
(7.44)
В уравнении (7.44)концентрация растворенного реагента на границе раздела фаз сA,bвыражена через парциальное давление этого вещества на границе радела фаз в соответствии с уравнением (7.42).
В условиях равновесия скорости массоотдачи от газовой фазы к жидкой или от жидкой фазы к газовой равны между собой и равны скорости массопередачи wA в целом.
Почленно складывая уравнения (7.43)и (7.44), получим уравнение, не содержащее неизвестного значения парциального давления ρА,bна границе раздела фаз:
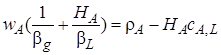
или
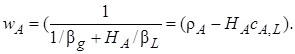 (7.45)
(7.45)
Уравнение (7.45)для расчета скорости массопередачи содержит лишь экспериментально определяемые величины ρА (парциальное давление растворяемого компонента в газовой фазе) и сА,L(концентрация этого компонента в основной массе жидкости), а также коэффициент массопередачи
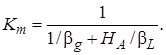 (7.46)
(7.46)
В уравнение (7.46) для определения коэффициента массопередачи Кт входят коэффициенты массоотдачи βg и βL,которые, как правило, могут быть определены с помощью критериальных уравнений, описывающих абсорбционные процессы в различных аппаратах. Константа фазового равновесия HА определяется по равновесным данным о растворимости газов.
При протекании процессов массопередачи сопротивление может быть равномерно распределено в жидкой или газовой фазе. Возможны также случаи, когда преобладает сопротивление в жидкой фазе или, наоборот, в газовой.
Например, если сопротивление сосредоточено в основном в газовой фазе, т. е. 1/βg>>HA/βL, уравнение (7.45) примет более простой вид:
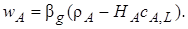
Если же вещество А, растворившись, вступает в быструю химическую реакцию с компонентами, находящимися в жидкой фазе, его концентрация в основной массе жидкости будет пренебрежимо мала и тогда
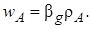
Наличие или отсутствие лимитирования процесса массоотдачей в одной из фаз в значительной степени зависит от числового значения константы Генри HА. При малых значениях НА,что отвечает высокой растворимости газа в жидкости [см. уравнение (7.39)],
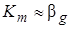 ,
,
т. е., как и в описанном выше случае, процесс абсорбции лимитируется массоотдачей в газовой фазе.
При больших значениях НА

т. е. сопротивление массопередаче сосредоточено в жидкой фазе.
Кинетические модели газожидкостных реакций. В промышленных условиях взаимодействие газообразных и жидких реагентов происходит, как правило, в проточных реакторах, где на процесс абсорбции значительное влияние оказывает интенсивность перемешивания. Перемешивание газожидкостной системы ведет к увеличению и обновлению поверхности контакта фаз и тем самым способствует росту производительности реактора.
Перемешивание может осуществляться разными методами. Одним из вариантов перемешивания является применение барботажа газа через жидкость (например, в тарельчатых колоннах), когда его пузырьки служат своеобразными перемешивающими агентами. Жидкость может перемешиваться и механическими мешалками, в том числе и при одновременном использовании пузырьков газа. Перемешиванию жидкости способствует турбулентный характер движения потока при ее стекании по вертикальной или наклонной стенке. Возможно, также распределение жидкости в виде капель или струи в газовом потоке.
Во всех этих случаях для абсолютно строгого описания процесса абсорбции необходимо совместно решить уравнения диффузионного и конвективного переноса, химической кинетики и т. д. Часто затруднительно не только решить, но и правильно составить такую систему уравнений. Поэтому на практике используют упрощенные модели, которые, однако, достаточно хорошо подтверждаются экспериментальными данными. Наиболее распространены пленочная модель и модели обновления поверхности.
Пленочная модель основывается на предположении о том, что у поверхности жидкости, граничащей с газом, имеется неподвижная пленка (диффузионный слой) толщиной δ. В пределах этой пленки газообразный реагент переносится исключительно вследствие молекулярной диффузии при полном отсутствии конвективного переноса. Принимается, что состав основной массы жидкости за пределами пленки однороден вследствие перемешивания, а изменение концентрации растворяемого реагента от величины сА,g (постоянная концентрация в газовой фазе) до cA,L(концентрация в основной массе жидкости) происходит внутри пленки (см. рис. 7.8, а, б). При отсутствии химической реакции между растворяемым компонентом А и растворителем профиль концентрации компонента А будет линейным (линия 1). Массоотдача от газа к жидкости через пограничную пленку описывается законом Фика для молекулярной диффузии:
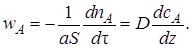
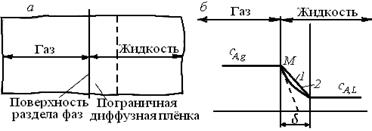
Рис. 7.8. Схема пленочной модели (а)
и профиль изменения концентрации растворяемого компонента А (б):
1, 2 – соответственно при отсутствии и наличии химической реакции
В стационарном режиме поток через поверхность будет постоянным, следовательно, при постоянстве коэффициента молекулярной диффузии
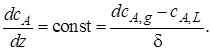 (7.47)
(7.47)
Тогда
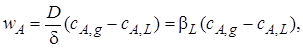
где βL – коэффициент массоотдачи в диффузионной пленке.
Коэффициент массоотдачи
 (7.48)
(7.48)
При химической реакции между растворяемым реагентом А и веществом В, находящимся в жидкой фазе,
а А + bВ  Продукты
Продукты
газ жидкость
уменьшение концентрации реагента А в пограничной пленке происходит не только вследствие диффузионных процессов, но и в связи с расходованием его на реакцию. Профиль концентрации в пограничном слое вследствие этого искривляется (кривая 2). Это приводит к увеличению градиента концентрации реагента у границы раздела фаз (растет числовое значение тангенса угла наклона касательной к кривой сА(z) в точке М,равное grad cA). В результате произойдет увеличение скорости переноса вещества из газовой фазы в жидкую wA = D grad сA, что, как указывалось, и является характерной чертой газожидкостных реакций.
Формально в рамках пленочной модели можно ввести и коэффициент ускорения абсорбции под влиянием химической реакции. Криволинейный профиль концентрации реагента А внутри пограничной пленки при наличии реакции можно условно изобразить ломаной линией (рис. 7.9). В соответствии с этим приближением изменение концентрации реагента происходит в пленке, имеющей толщину δ/. «Уменьшение» толщины пленки приведет к росту коэффициента массоотдачи
 (7.49)
(7.49)
где β/L – коэффициент массоотдачи при наличии химической реакции; ε – коэффициент ускорения абсорбции при наличии химической реакции, показывающий, во сколько раз увеличится скорость абсорбции при наличии химической реакции в жидкой фазе (ε =β/L /βL).
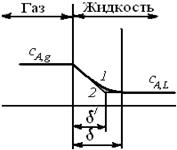
Рис. 7.9. Аппроксимация нелинейного концентрационного
профиля при наличии химической реакции:
1 – реальный (нелинейный); 2 – приближенный
С учетом уравнения (7.49)выражение (7.46)примет вид
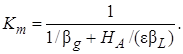
Если модель двухпленочная,считают, что пограничный диффузионный слой, примыкающий к границе раздела фаз, имеется со стороны не только жидкой фазы, но также и газовой фазы.
Пленочная модель газожидкостных реакций лишь приближенно описывает гетерогенный процесс в системе «газ – жидкость». В действительности, конечно, изменение концентрации растворяемого реагента происходит не только внутри очень тонкой пленки, имеющей к тому же везде одинаковую толщину, но и в основной массе потока. Однако, как показала практика, количественные расчеты на основе пленочной модели, как правило, мало отличаются от результатов, полученных с использованием более сложных моделей. Поэтому применение пленочной модели, опирающейся на сравнительно простой математический аппарат, часто является оправданным.
Модели обновления поверхности (или модели проницания) основываются на предположении о том, что через некоторые промежутки времени происходит замещение элементов жидкости у поверхности раздела фаз жидкостью из глубинных слоев, состав которой такой же, как и средний состав основной массы. Пока элемент жидкости находится у поверхности и соприкасается с газом, абсорбция газа жидкостью происходит при таких условиях, как если бы этот элемент был неподвижен и имел бесконечную глубину. Скорость абсорбции является в такой модели функцией предполагаемого «времени пребывания» элемента жидкости у поверхности раздела фаз. В начальный период, когда τ = 0, скорость велика, а по мере увеличения времени пребывания уменьшается.
Таким образом, абсорбцию газа жидкостью в соответствии с моделями обновления поверхности рассматривают как нестационарный процесс, когда условия абсорбции непостоянны во времени.
В первоначальном варианте модели обновления поверхности принимали, что каждый элемент жидкости у поверхности соприкасается с газом перед заменой другим элементом жидкости основного состава в течение одного и того же промежутка времени τ. За это время элемент жидкости абсорбирует единицей своей поверхности одно и то же количество Q газа, соответствующее сделанным предположениям о неподвижности жидкости. Средняя скорость абсорбции составит Q/τ.
В действительности время пребывания отдельных элементов жидкости у поверхности раздела фаз неодинаково. В разных вариантах моделей обновления поверхности принимают различные виды распределения времени пребывания отдельных элементов жидкости.
Модели обновления поверхности для случая абсорбции газов перемешивающимися жидкостями представляются более реалистичными. Однако математический аппарат, используемый в них, существенно сложнее, чем у пленочной модели. В то же время количественные прогнозы, сделанные на основе пленочной модели, как правило, мало отличаются от расчетов, выполненных на основе моделей обновления поверхности.
Вопросы и упражнения для повторения и самостоятельной работы
1. В чем заключается главная кинетическая особенность гетерогенных химических процессов?
2. Какие кинетические модели обычно используют для описания гетерогенных процессов в системах «газ – твердое», «газ – жидкость»?
3. Какой смысл вкладывается в понятия «кинетическая область гетерогенного процесса» и «диффузионная область»?
4. Как увеличить коэффициент массоотдачи на стадии внешней диффузии?
5. Выведите уравнение для расчета константы скорости гетерогенного процесса в системе «газ – твердое», включающего химическую реакцию первого порядка.
6. Изобразите профиль изменения концентрации газообразного реагента, при протекании гетерогенного процесса, описываемого моделью с фронтальным перемещением зоны реакции в случаях:
а) когда гетерогенный процесс лимитируется внешней диффузией;
б) когда гетерогенный процесс лимитируется внутренней диффузией;
в) когда гетерогенный процесс лимитируется химической реакцией;
г) когда гетерогенный процесс не имеет лимитирующей стадии (протекает в переходной области).
7. Сформулируйте основные свойства лимитирующей стадии.
8. Как определить лимитирующую стадию гетерогенного процесса, экспериментально изучая влияние температуры на скорость образования продуктов в ходе этого процесса?
9. Как определить лимитирующую стадию гетерогенного процесса в системе «газ – твердое», используя теоретические зависимости между временем пребывания в реакторе и степенью превращения твердой фазы для различных областей протекания гетерогенного процесса?
10. В чем заключаются различия в расчете реакторов для проведения гетерогенных процессов в системе «газ – твердое» в случаях, когда твердая фаза состоит из частиц одного размера и когда она характеризуется каким-то распределением частиц по размерам?
11. Какая величина называется коэффициентом ускорения абсорбции? Почему можно говорить об ускорении абсорбции, если в жидкой фазе протекает химическая реакция?
Дата добавления: 2015-06-17; просмотров: 9737;
