Общие представления о катализе
Катализаторы – это вещества, которые, многократно вступая в промежуточное взаимодействие с участниками реакции, изменяют ее механизм и увеличивают скорость реакции. Они восстанавливают свой химический состав после каждого цикла промежуточных взаимодействий.
Влияние катализатора на механизм химической реакции можно пояснить на условном примере. Пусть протекает одностадийная реакция с энергией активации E0
А+В  R.
R.
Ход реакции на энергетической диаграмме (см. рис. 8.1) изображен кривой 2. В присутствии катализатора механизм реакции изменяется, она протекает через несколько последовательных стадий (кривая 1). Например, первой стадией может быть образование промежуточного активированного комплекса (АКт):
А + Кт  АКт
АКт
(здесь Кт – катализатор). Затем активированный комплекс реагирует со вторым реагентом с образованием комплекса катализатора и продукта:
АКт + В  RKt.
RKt.
Последней стадией является разложение комплекса RKt с образованием продукта R и высвобождением катализатора для нового каталитического цикла:
RKт  R + Кт.
R + Кт.
Каждая из этих последовательных стадий характеризуется своими значениями энергии активации E1, E2, Е3(кривая 2), но, как правило, высота каждого из этих потенциальных барьеров ниже энергии активации Е0. Таким образом, в присутствии катализатора реакция протекает по энергетически более выгодному пути, что позволяет проводить процесс с большей скоростью.
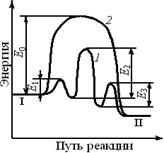
Рис. 8.1.Энергетические диаграммы каталитической и некаталитической реакций. Энергетический уровень: I– исходных реагентов; II – продуктов реакции; 1 – путь каталитической реакции; 2 – путь реакции без катализатора
Исходное (I) и конечное (II) энергетические состояния реакционной системы в присутствии катализатора и без него остаются одинаковыми. Следовательно, катализатор не может изменить состояние химического равновесия, которое не зависит от пути реакции.
Роль катализатора состоит в изменении скорости достижения состояния равновесия. Катализатор может увеличивать скорость только тех процессов, которые разрешены термодинамически, но не может инициировать реакции, протекание которых невозможно при данных условиях в соответствии с законами химической термодинамики.
Некоторые химические реакции без катализаторов практически неосуществимы, например, из-за слишком большой энергии активации. Казалось бы, что для преодоления высокого энергетического барьера можно повысить кинетическую энергию молекул, т. е. увеличить температуру. Но для многих обратимых экзотермических реакций повышение температуры приводит к смещению равновесия в обратную сторону и делает реакцию неразрешенной термодинамически. В таких случаях применение катализатора не только оправдано, но и необходимо. Катализатор снижает энергию активации реакции и позволяет тем самым проводить ее при существенно более низких температурах.
В качестве примера рассмотрим реакцию синтеза аммиака, характеризующуюся очень большим значением энергии активации (примерно 280 кДж/моль). Для преодоления такого высокого энергетического барьера реагенты необходимо было бы нагреть до температур выше 1000 °С, при которых равновесная степень превращения даже при очень высоких значениях давления ничтожно мала.
В присутствии катализатора на основе железа энергия активации синтеза аммиака снижается примерно до 160 кДж/моль, что позволяет проводить реально процесс с достаточно высокой скоростью при температурах 400–500 °С и высоких давлениях, достигая 20–35%-ной степени превращения исходного сырья.
Чрезвычайно важна роль катализаторов в осуществлении сложных реакций, так как катализаторы обладают способностью избирательно влиять на скорость только какой-то одной нужной реакции. Так, например, сейчас трудно представить процесс крекинга нефтепродуктов (система сложных последовательных и параллельных реакций) без селективно действующих цеолитных катализаторов, позволяющих направить процесс в сторону получения высококачественного бензина.
Каталитические процессы подразделяют на две большие группы: гомогенные и гетерогенные. Наибольшее распространение в промышленности получили гетерогенно-каталитические процессы. В свою очередь, при протекании подавляющего большинства гетерогенно-каталитических процессов границей раздела фаз служит поверхность твердого катализатора, находящегося в газообразной или жидкой реакционной среде. Существенным преимуществом таких процессов является простота разделения продуктов реакции и частиц катализатора для повторного использования катализатора.
В конце XX в. активно развивались новые направления катализа, которые в какой-то степени сближают гомогенный и гетерогенный катализ. Большие перспективы открывает иммобилизация гомогенных комплексных катализаторов в полимерных гелях, т. е. закрепление их на макромолекулах химическим или иным связыванием. Новые возможности проведения технологических процессов в сравнительно мягких условиях (невысокие значения температуры, давления) могут появиться с использованием катализа на иммобилизованных ферментах. Хотя это направление еще не получило широкого развития вследствие высокой стоимости ферментов, развитие современной биотехнологии и инженерной генетики обеспечивает все большую доступность ферментов.
В данной главе будут рассмотрены особенности кинетики гетерогенно-каталитических процессов применительно к системе «твердый катализатор – газообразная (жидкая) реакционная среда».
Дата добавления: 2015-06-17; просмотров: 2329;
