Технологические характеристики твердых катализаторов
Подбор катализаторов для проведения промышленных процессов – задача чрезвычайно сложная. Катализаторы очень специфичны по отношению к различным химическим реакциям. Существующие теории катализа объясняют эту специфичность рядом энергетических и геометрических факторов, в результате влияния которых данный катализатор воздействует на скорость только одной реакции или очень узкой группы реакций. Не всегда еще возможен строгий научный выбор конкретного катализатора для данного химико-технологического процесса, хотя теория каталитических процессов в последние десятилетия получила значительное развитие и характеризуется многими новыми достижениями.
Твердые катализаторы – это, как правило, высокопористые вещества с развитой внутренней поверхностью, характеризующиеся определенной пористой и кристаллической структурой, активностью, селективностью и рядом других технологических характеристик.
Рассмотрим некоторые характеристики твердых катализаторов.
Активность.При сравнении разных катализаторов обычно выбирают более активный, если он удовлетворяет основным технологическим требованиям.
Активность катализатора – мера ускоряющего воздействия по отношению к данной реакции.
Всвязи с большим разнообразием каталитических процессов не существует единого количественного критерия активности. Это связано с тем, что применение различных катализаторов даже для одной и той же химической реакции может по-разному изменить ее механизм. Как правило, применение катализатора приводит к изменению и порядка реакции, и энергии активации, и предэкспоненциального множителя.
Количественным критерием активности катализатора для данной реакции может служить, например, константа скорости, измеренная для разных катализаторов в сопоставимых условиях (стандартных). Такой подход применим, если для всех сравниваемых катализаторов данной группы остается одинаковым порядок реакции.
Иногда сравнивают катализаторы по скорости реакции или степени превращения реагентов в стандартных условиях, по количеству реагентов, вступающих во взаимодействие в единицу времени на единице поверхности катализатора (производительности, или напряженности, катализатора) и т. п.
В технологических расчетах часто каталитическую активность определяют скоростью реакции в стандартных для этой реакции условиях, отнесенной к единице объема или массы катализатора.
Если каталитическая реакция имеет такой же порядок, что и некаталитическая, т. е. их константы скорости kKти k имеют одинаковые единицы измерения, активность катализатора А можно определить, как отношение констант
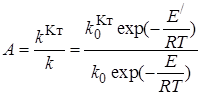 , (8.1)
, (8.1)
где Е' и Е – энергии активации каталитической и некаталитической реакции.
Из уравнения (8.1)следует, что активность тем выше, чем больше снижается активация в присутствии катализатора. Однако следует иметь в виду, что в присутствии катализатора меняется не только энергия активации, но и предэкспоненциальный множитель. Рост активности вследствие снижения энергии активации сдерживается уменьшением 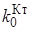 по сравнению с k0(имеет место так называемый компенсационный эффект).
по сравнению с k0(имеет место так называемый компенсационный эффект).
Температура зажигания.Наряду с активностью важной технологической характеристикой является температура зажигания катализатора Tзаж.
Температура зажигания – это минимальная температура, при которой технологический процесс начинает идти с достаточной для практических целей скоростью.
Понятие «зажигание» означает, что при возрастании температуры выше предельной, равной Tзаж,происходит резкое, скачкообразное увеличение скорости реакции. «Зажигание» может иметь место и в некаталитических реакциях.
Рассмотрим, например, графическое решение системы уравнений материального и теплового балансов проточного реактора при проведении в нем экзотермической реакции (см. рис. 8.2). Если начальная температура реакционной смеси равна T1, в реакторе не может быть установлена высокая температура и, следовательно, высокая скорость реакции, при которой глубина превращения за заданное время пребывания будет достаточно высокой. Предположим теперь, что линия 2,описывающая уравнение теплового баланса, будет касательной в точке А к линии 1 уравнения материального баланса. Тогда совсем небольшое изменение начальной температуры на входе в реактор от T1 – ∆T до T1 + ∆T приведет к скачкообразному изменению достигаемой в реакторе степени превращения от хА,1 до хА,2. Это означает, что при тех же значениях объема реактора и объемного расхода реагентов через него произошло резкое возрастание скорости реакции (и одновременно скорости тепловыделения).

Рис. 8.2.Уравнения материального и теплового балансов
проточного реактора (совместное решение)
Следовательно, температура Т2 и является температурой зажигания. Числовое значение T2 на рис. 8.2 (и соответственно положение точки А) определяется в первую очередь кинетическими особенностями реакции, влияющими на положение линии 1 уравнения материального баланса. Так как каждый катализатор характеризуется своими кинетическими параметрами, то и температура зажигания будет различной для разных катализаторов.
С технологической точки зрения лучше использовать катализаторы снизкой температурой зажигания, что позволяет снизить энергетические затраты на предварительный нагрев реакционной смеси.
Для экзотермических реакций понятие «температура зажигания» может быть конкретизировано количественно. Чем меньше температура проведения процесса, тем ниже скорость реакции и тем меньше выделяется теплоты. При некоторой минимальной температуре (температура зажигания) скорость выделения теплоты становится равной скорости отвода теплоты (расходу теплоты на нагрев исходной реакционной смеси и выносу теплоты с продуктами реакции). Таким образом, температура зажигания для экзотермических реакций – это минимальная температура, при которой процесс можно проводить в автотермическом режиме, без подвода теплоты извне.
Особенно важно иметь невысокую температуру зажигания катализатора при проведении обратимых экзотермических реакций, тогда невысокие температуры проведения процесса позволяют сместить равновесие реакции в сторону ее продуктов.
Селективность. Сложные каталитические реакции могут протекать по нескольким термодинамически возможным направлениям с образованием большого числа различных продуктов. Преобладающее течение реакции зависит от используемого катализатора, причем не всегда ускоряется процесс, термодинамически самый выгодный из нескольких возможных.
Селективностью, или избирательностью, катализатора называют его способность избирательно ускорять целевую реакцию при наличии нескольких побочных.
Количественно селективность катализатора можно оценить как селективность процесса (см. § 1.2) – интегральную или дифференциальную.
Если одновременно протекает несколько параллельных реакций, можно подобрать разные селективные катализаторы для каждой из этих реакций. Например, в присутствии оксида алюминия или оксида тория этанол разлагается преимущественно на этилен и воду:
С2Н5ОН  С2Н4 + Н2О.
С2Н4 + Н2О.
В присутствии серебра, меди и других металлов практически имеет место только реакция дегидрирования спирта с образованием уксусного альдегида:
С2Н5ОН  СН3СНО + Н.
СН3СНО + Н.
В присутствии смешанного катализатора (А12О3 + ZnO) с достаточно высокой селективностью идут реакции дегидратации и дегидрирования с образованием бутадиена:
2С2Н5ОН  С4Н6 + 2Н2О + Н2.
С4Н6 + 2Н2О + Н2.
Селективность зависит не только от выбранного катализатора, но и от условий проведения процесса, области протекания гетерогенно-каталитического процесса (кинетической, внешне- или внутреннедиффузионной) и т. д.
Пористая и кристаллическая структура катализатора.Важным свойством катализатора является пористая структура, которая характеризуется размерами и формой пор, пористостью (отношением свободного объема пор к общему объему), удельной поверхностью катализатора (т. е. приходящейся на единицу массы или объема).
При выборе твердого вещества, которое должно служить активным катализатором для гетерогенных газовых реакций, важную роль играет доступность поверхности катализатора для реагирующих газов. Чем больше для каждого данного катализатора поверхность, доступная для реагирующего газа, тем выше скорость расходования реагентов в единицу времени при использовании того же количества катализатора.
Промышленные катализаторы всегда имеют развитую внутреннюю поверхность, иначе внешняя поверхность, весьма небольшая, быстро подвергалась бы отравлению, и катализатор вскоре утрачивал бы активность. Чем выше пористость катализатора и чем меньше диаметр пор, тем больше внутренняя поверхность. Современные катализаторы характеризуются большими значениями удельной поверхности (до 10–100м2/г).
Однако распределение пор по размерам может оказаться таким, что часть поверхности катализатора окажется совершенно недоступной для реагирующих молекул большого размера и, кроме того, скорость превращения реагентов в конечные продукты может уменьшаться вследствие затруднения диффузии реагентов внутри пор.
Для получения катализаторов с развитой пористой структурой используют специальные методы их приготовления. Стараются применять в качестве катализаторов природные или искусственные высокопористые адсорбенты (алюмосиликаты, цеолиты, силикагель, активированный уголь и т. д.). Эти вещества употребляют также как носители, на поверхность которых наносят активные компоненты.
Наряду с пористой структурой большое значение имеет кристаллическая структура катализаторов. Различные кристаллические модификации одного и того же вещества могут обладать сильно отличающейся каталитической активностью. Например, переход γ – А12О3 в α – А12О3 на несколько порядков снижает активность этого вещества как катализатора дегидрирования.
Промотирование и отравление катализаторов.Часто введение очень небольшого количества (долей процента) какой-либо посторонней добавки к основному катализатору приводит либо к резкому повышению его активности, либо, наоборот, к снижению активности на несколько порядков. В первом случае говорят о промотировании, во втором – об отравлении катализатора.
Механизм промотирования твердых катализаторов может быть различным. Добавки могут вступать с основным катализатором в химическое взаимодействие, образуя на поверхности продукты, обладающие более высокой каталитической активностью. Они могут изменить условия взаимодействия с реагентами в местах контакта основного компонента и промотора, а также увеличить дисперсность или стабилизировать пористую и кристаллическую структуру катализатора и т. п.
Например, каталитическая активность V2O5 по отношению к реакции окисления диоксида серы повышается в сотни раз при добавлении небольших количеств сульфатов щелочных металлов; введение 2–3 % А12О3 в катализатор синтеза аммиака позволяет создать стабильную геометрическую структуру, не меняющуюся под воздействием реакционной среды в течение длительного времени.
Практическому использованию каталитических процессов часто препятствует снижение активности катализатора при воздействии на него веществ, называемых каталитическими ядами. Например, если в газе, поступающем для окисления SO2 на ванадиевом катализаторе, содержание SiF4 составляет 4–5 мг/м3, происходит резкое снижение каталитической активности.
Это объясняется теорией активных центров, согласно которой каталитическую активность проявляет не вся поверхность катализатора, а лишь некоторые ее участки, обладающие определенным энергетическим и геометрическим соответствием реагирующим молекулам, – активные центры. Каталитические яды блокируют активные центры, образуя с ними поверхностные химические соединения.
Отравление бывает обратимым и необратимым. При обратимом отравлении активность катализатора постепенно восстанавливается, если в реакционной смеси больше не содержится каталитического яда. При необратимом отравлении действием свежей реакционной смеси активность восстановить не удается. Одно и то же вещество может вызвать и обратимое и необратимое отравления, в зависимости от продолжительности его действия, концентрации в реакционной смеси, температуры процесса.
Например, для железного катализатора синтеза аммиака каталитическими ядами являются кислород и кислородосодержащие соединения (СО, СО2, Н2О). При содержании 1∙10–2 % СО в газовой смеси, поступающей на катализатор, работающий при давлении 30 МПа и температуре 450 °С, через 6 сут. активность катализатора уменьшается на 25 %. Его активность можно полностью восстановить за 1 сут. работы с чистым газом. При содержании 5∙10–2 % СО в исходном газе через 3 сут. активность катализатора падает на 67 %, а через 4 сут. работы на чистом газе полностью восстанавливается. При температуре 500 °С и содержании 5∙10–3 % О2 концентрация в газе на выходе падает на 4 % и применение чистого газа уже не восстанавливает прежнюю активность катализатора.
Для удлинения срока службы катализатора в промышленных условиях в технологических схемах предусматривают тщательную очистку реагирующих веществ от примесей, являющихся каталитическими ядами (например, в производстве серной кислоты – от соединений мышьяка и фтора, в производстве аммиака – от СО, СО2, сернистых соединений и т. д.).
В ряде случаев катализатор отравляется побочными продуктами реакции. Так, в реакциях органических соединений (крекинга, дегидрирования, изомеризации) отравление катализаторов часто происходит в результате образования высокоуглеродистой полимерной пленки (так называемого кокса), покрывающей поверхность катализатора. Для ее удаления цикл катализа сменяют циклом регенерации – катализатор продувают при высокой температуре воздухом для перевода кокса в СО2.
Дата добавления: 2015-06-17; просмотров: 3409;
