Механизм биологической фиксации молекулярного азота
Как известно, атомы в молекуле азота (N2) соединены тремя ковалентными связями, энергия диссоциации которых равна 9,4 • 105 дж/молъ. Наибольшей энергией — 5,3-105 дж/молъ — обладает первая связь, вторая — 2,5-105 дж/молъ, третья — 1,6 • 105 джмолъ. Эти связи очень прочны, и молекулы азота поэтому химически инертны. Именно инертность азота обусловливает необходимость его активации, так же как и повышения химической активности вступающего с ним в реакцию соединения или элемента.
Синтез аммиака из атмосферного азота химическим путем, осуществляемый методом Габе-ра — Боша, происходит при температуре 400— 500 °С и высоком давлении (200—1000 атм). Клетки микроорганизмов проводят процесс азотфиксации в обычных условиях.
Каким образом фиксируют азот микроорганизмы, если и здесь сохраняется в силе требование больших энергетических затрат для активации молекулы азота? Может быть, их энергетический обмен дает такую возможность? В самом деле, у азотфиксаторов, как указывает В. Л. Кретович (1964), интенсивность энергии обмена, в частности степень потребления кислорода, значительно выше, чем у бактерий, неспособных фиксировать азот. И ферменты у них более активные. Однако, каким путем эта энергия используется в процессе азотфик-сации, до сих пор еще точно не установлено. В современных гипотетических схемах механизма азотфиксации несомненное предпочтение отдается восстановительному характеру превращений молекулярного азота, о чем в 20-е годы этого столетия утверждали наши замечательные соотечественники С. П. Костычев и С. Н. Виноградский, выдвигая «аммиачную теорию» фиксации атмосферного азота. У всех свободноживущих азотфиксирующих микроорганизмов, а также и при симбиотиче-ской азотфиксации аммиак (NHs) обнаружен в качестве первого стабильного продукта этого процесса.
Наиболее вероятно, что разрыв связей в молекуле азота происходит не сразу, а последовательно, в результате действия ферментных систем.
В. Е.Шилов и Г.И.Лихтенштейн (1971) предложили интересный механизм активации азота ферментом нитрогеназой (рис. 179). Молекулярный азот через щель размером 4—5 А (это соответствует длине молекулы азота) поступает внутрь фермента и здесь активируется. В его активации большая роль принадлежит молибдене- и железосодержащим центрам, по цепям атомов которых происходит эстафетная передача активирующих азот электронов от восстановителя. Реакции активации способствует близость группировок серы.
В результате активации и хемосорбции азота нитрогеназой высвобождается энергия и происходит разрыв двух связей в молекуле азота. На это расходуется 7,8*105 дж/моль. Третья связь разрывается при внедрении в молекулу активированного азота: водорода, активированного, в свою очередь, ферментами дегидрогена-зной и гидрогеназной систем. Получающийся аммиак или другие восстановленные продукты азота реагируют с кетокислотами, образуя аминокислоты.
В симбиотических азотфиксирующих системах фиксация азота осуществляется в результате сложного взаимодействия микроорганизма и высшего растения. Несомненно, механизм процесса азотфиксации в клубеньках имеет своеобразные особенности, обусловленные совместным функционированием двух совершенно различных по своим свойствам партнеров, присутствием леггемоглобина, принимающего участие в процессе фиксации, и наличием бактероидов.
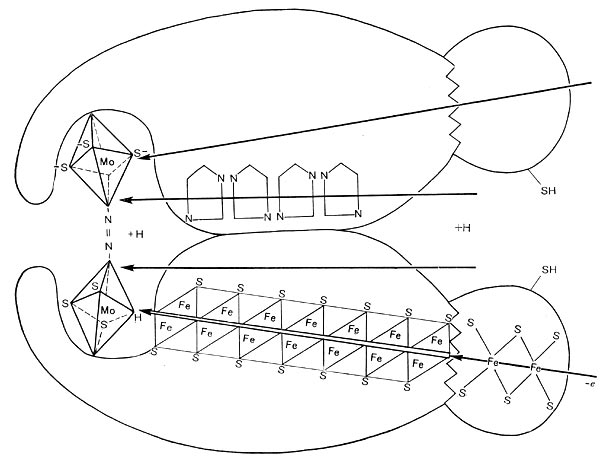
Рис. 179. Схема действия нитрогеназы.
Процесс фиксации в симбиотической системе иллюстрируется схемой (рис. 180), где видно, что растение и бактерии функционируют в единстве и что электрон-транспортной цепью между ними является леггемоглобин.
Высшее растение по схеме является источником углеродсодержащих соединений. Их трансформация обеспечивает получение энергетического материала для процессов активации и восстановления N2. Активированный азот — конечный акцептор электронов. Продукты неполного окисления углеродсодержащих соединений служат акцепторами NHs и в клубеньках образуют аминокислоты, которые становятся доступными высшему растению. Растения выполняют роль накопителя углеродсодержащих соединений (продуктов фотосинтеза) и поставщика энергии. Клубеньковые бактерии в стадии бактероидов проявляют способность с помощью нитрогеназы переносить активированный водород к азоту. Путь от Na до NHs рассматривается как восстановительный процесс.
В последнее время получены доказательства локализации процесса азотфиксации в бактероидах с помощью измерения азотфиксирую-щей активности у фракции бактероидов, которую отделяли центрифугированием от других фракций клубенька.

Рис. 80. Схема симбиотической азотфиксации
Дата добавления: 2015-06-12; просмотров: 1164;
