Образование активной формы глюкозы (УДФ-глюкозы)
1. Глюкоза фосфорилируется с затратой молекулы АТФ до глюкозо-6-фосфата. Это та же реакция, которая является первой в процессе гликолиза. Фосфорилирование глюкозы катализируется в мышцах ферментом гексокиназой, а в печени – глюкокиназой.
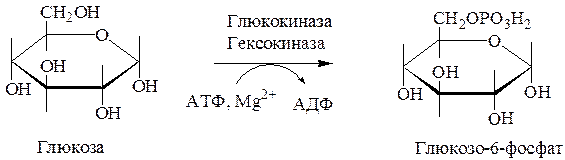
2. Под действием фосфоглюкомутазы глюкозо-6-фосфат превращается в глюкозо-1-фосфат.
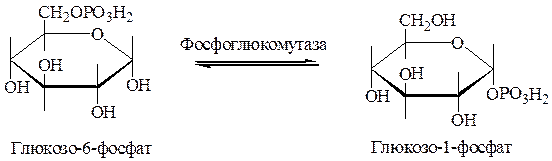
3. Глюкозо-1-фосфат взаимодействует с УТФ с участием фермента глюкозо-1-фофатуридилтрансфераза, в результате образуется УДФ-глюкоза и пирофосфат. Пирофосфат расщепляется пирофосфотазой до 2-х молекул неорганического фосфата, что делает реакцию необратимой.
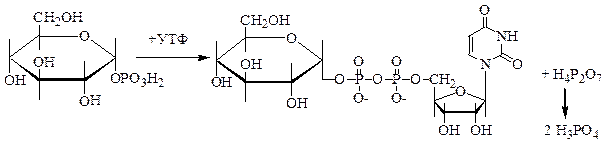
Образовавшаяся УДФ-глюкоза является переносчиком и донором активированных остатков глюкозы в последующей реакции синтеза гликогена. Эта функция нуклеозиддифосфатсахаров была установлена аргентинским биохимиком Л.Лелуаром, удостоенным Нобелевской премии за эти работы.
Образование α-1,4-гликозидной связи
Для образования α-1,4-гликозидной связи необходимо наличие затравки гликогена – небольшой молекулы гликогена, состоящего из не менее 4-х остатков глюкозы. Под действием фермента гликогенсинтазы образуется гликозидная связь между С1 атомом активированной глюкозы, находящейся в составе УДФ-глюкозы и С4 атомом концевого остатка глюкозы в молекуле гликоген-затравки с высвобождением УДФ.
УДФ-глюкоза + (С6Н12О6)n → УДФ + (С6Н12О6)n+1
У растений донором гликозильных групп при синтезе крахмала служит АДФ-D-глюкоза, а не УДФ-производные.
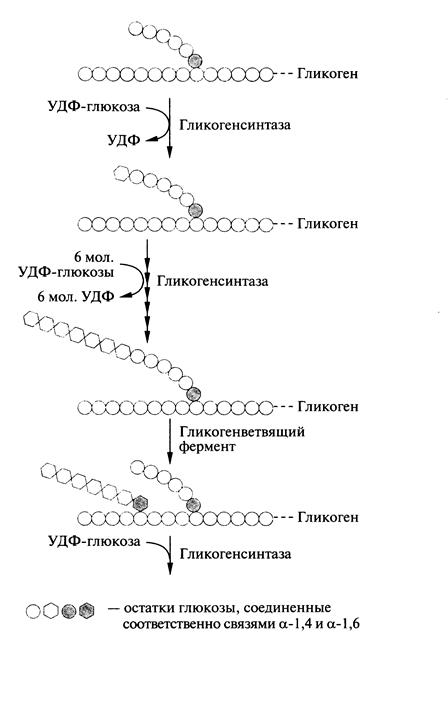
Рис.8.1. Ветвление структуры гликогена
Образование α-1,6-гликозидной связи
Присоединение остатка глюкозы к «затравочной» цепи гликогена происходит на внешнем конце молекулы. «Ветви» гликогенового «дерева» удлиняются путем последовательного образования α-1,4-гликозидных связей. После того, как длина линейного участка цепи достигнет как минимум 11 остатков глюкозы, ветвящий (браншинг) фермент (амило[1,4]→[1,6]-трансглюкозидаза) переносит фрагмент (1→4) цепи из 6-7 остатков глюкозы на ту же или соседнюю цепь, присоединяя переносимый фрагмент (1→6) связью (рис. 8.1). Таким образом, образуется точка ветвления в молекуле.
Гликогенолиз– это процесс расщепления гликогена, приводящий к вовлечению глюкозных остатков этого запасного полисахарида в гликолиз.
Существует 2 пути распада внутриклеточного гликогена: гидролитический или амилолитический (более древний) и фосфоролитический. При гидролитическом пути распад гликогена осуществляется под действием фермента γ-амилазы в печени в присутствии воды и образуется свободная глюкоза.
Фосфоролитический путь является основным путем распада гликогена у животных и катализируется ферментом фосфорилазой.
(С6Н12О6)n + Н3РО4 → (С6Н12О6)n-1 + Глюкозо-1-фосфат.
Фосфоролитическое расщепление гликогена энергетически выгодно, т.к. высвобождается фосфорилированная глюкоза. Кроме того, фосфорилированная глюкоза в мышечной ткани не может высвобождаться в кровь вследствие отсутствия фермента глюкозо-6-фосфатазы.
Фосфоролитическое расщепление гликогена включает несколько стадий.
1. Фермент фосфорилаза специфично катализирует расщепление α-1,4-гликозидных связей гликогена. Остатки глюкозы отщепляются от концов молекулы гликогена до тех пор, пока на ветвях, идущих от точки ветвления не останется примерно по 4 остатка глюкозы.
2. Фермент α-1,4→1,4-глюкантрансфераза переносит трисахаридный фрагмент с одной цепи на другую, открывая α-1,6-гликозидную связь.
3. Гидролитическое расщепление α-1,6-гликозидной связи осуществляет ферментамило-1,6-гликозидаза (деветвящий, дебраншинг), что приводит к отщеплению одной молекулы свободной глюкозы и открывает для действия гликогенфосфорилазы новый участок, состоящий из остатков глюкозы, соединенных α-1,4-связями (рис. 8.2).
4. Из глюкозо-1-фосфата образуется глюкозо-6-фосфат. В печениимеется специфический фермент глюкозо-6-фосфатаза, который отщепляет фосфат от глюкозо-6-фосфата. Образовавшаяся глюкоза диффундирует из клеток в кровь и поглощается преимущественно мозгом и мышцами. Это заключительная стадия гликогенолиза в печени, приводящая к повышению содержания глюкозы в крови.
Главные ферменты, контролирующие метаболизм гликогена, - гликогенфосфорилаза и гликогенсинтаза – регулируются аллостерически и ковалентной модификацией путем фосфорилирования и дефосфорилирования фермента (рис. 8.3).
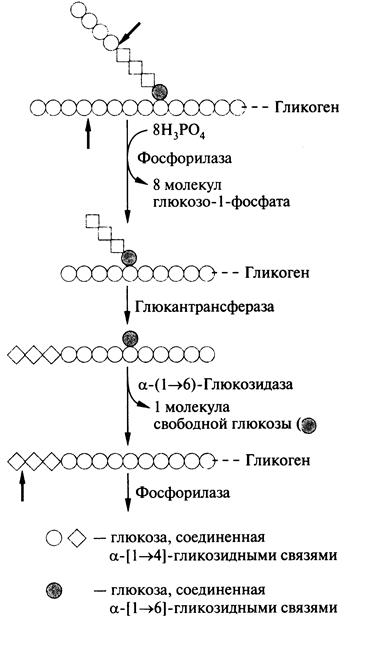
Рис. 8.2. Действие дебраншинг фермента
1. В печени фосфорилаза находится в активной и неактивной форме. Активная фосфорилаза (фосфорилаза а) – фосфорилированный тетрамер. Под действием специфической фосфатазы фосфорилаза а переходит в неактивную фосфорилазу b (димер) в результате гидролитического отщепления фосфата от остатка серина. Переход неактивной фосфорилазы b в фосфорилазу а происходит путем фосфорилированияпод действием киназы фосфорилазы.
2. Киназа фосфорилазы существует в 2-х формах – активной – фосфорилированной и неактивной– дефосфорилированной. Переход активной формы в неактивную осуществляется при отщеплении фосфорной кислоты. Активация киназы фосфорилазы происходит при участии фермента протеинкиназы.
3. Гликогенсинтаза может находиться в фосфорилированном и нефосфорилированном состоянии. Активна дефосфорилированнаяформа фермента – гликогенсинтаза I, которая переходит в неактивную гликогенсинтазу D (зависима от глюкозо-6-фосфата) путем фосфорилирования под действием протеинкиназы. Активация фермента происходит под действием фосфатазы путем отщепления остатков фосфорной кислоты.
4. Протеинкиназа состоит из 4-х субъединиц (тетрамер) – 2-х регуляторных (R) и 2-х каталитических (С). В комплексе фермент неактивен и активируется под действием циклического АМФ (цАМФ). 2 молекулы цАМФ присоединяются к каждой регуляторной субъединице протеинкиназы, что вызывает его диссоциацию с высвобождением каталитических субъединиц.
R2C2 + 4цАМФ → 2 С + 2 (R – 2 цАМФ)
Активная протеинкиназа переносит остаток фосфорной кислоты от АТФ на специфические белки (ферменты), что приводит к изменению их активности.
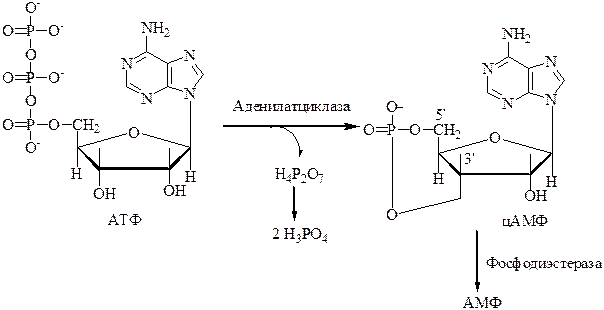
5. Образование цАМФ происходит из АТФ под действием фермента аденилатциклазы, который находится на внутренней поверхности мембраны и связан с рецептором для гормонов на внешней стороне мембраны.
6. Фермент фосфодиэстераза разрушает цАМФ путем разрыва кольца с образованием АМФ.
При голодании или в стрессовых ситуациях увеличивается потребность в глюкозе.
1. В мышце под действием адреналина и в печени – глюкагонаи адреналина происходит активация аденилатциклазы, которая приводит к образованию цАМФ. цАМФ, связываясь с R-субъединицей протеинкиназы, активирует ее. Протеинкиназа фосфорилирует киназу фосфорилазы и переводит ее в активную форму. Киназа фосфорилазы фосфорилирует фосфорилазу b и переводит ее в фосфорилазу а, что активирует распад гликогена. Инсулинингибирует аденилатциклазу и активирует фосфодиэстеразу, что уменьшает концентрацию цАМФ. Протеинкиназа, киназа фосфорилазы и фосфорилаза остаются в неактивной форме, что тормозит распад гликогена. Таким образом, происходит каскад ферментативных реакций, что создает высокую степень амплификации. При распаде гликогена – 3 ферментативных стадии контроля, при синтезе – 2.
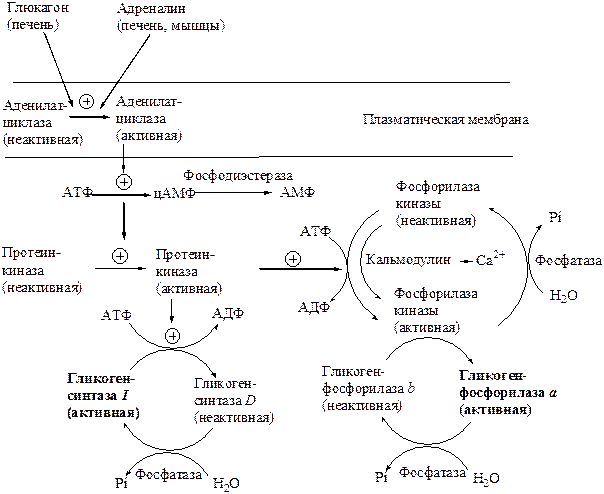
Рис. 8.3. Регуляция синтеза и распада гликогена
2. В состав мышечной фосфорилазы входит пиридоксальфосфат (витамин В6), необходимый для ее действия. В мышцах фосфорилаза b может активироваться аллостерически под действием АМФ, оставаясь при этом дефосфорилированной. АТФ действует как отрицательный аллостерический эффектор.
3. В мышцах сразу после мышечного сокращения гликогенолиз возрастает в несколько сотен раз. Процесс включает быструю активацию фосфорилазы через ионы кальция. Ионы Са2+ активируют киназу фосфорилазы, связываясь с субъединицей киназы фосфорилазы, идентичной Са2+-связывающему белку – кальмодулину.
4. Гликогенсинтаза D может активироваться аллостерически под действием глюкозо-6-фосфата. Инсулин стимулирует синтез гликогена в мышце, способствуя дефосфорилированию и активации гликогенсинтазы.
Дата добавления: 2015-06-12; просмотров: 7790;
