ВЫБОР СПОСОБА ОПЕРАТИВНОГО ВМЕШАТЕЛЬСТВА
Выбор способа оперативного вмешательства — ответственный этап в лечении больного с отслойкой сетчатки. При этом хирург должен принципиально решить 4 задачи: 1)выбор способа коагуляции с целью вызова слипчивого хориоретинального воспаления; 2) выбор материала для пломбирования; 3) выбор способа сближения сетчатки с хориоидеей; 4) выбор способа профилактики в случае необходимости на втором глазу.
Выбор способа коагуляции. Из описанных многочисленных способов вызова слипчивого воспаления (1,23,24,28,38,39,40,41,92) в настоящее время наиболее употребительны диатермо-, крио-, фото- и лазеркоагуляция. Диатермический способ вызова слипчивого воспаления практически вытесняется криопексиеи не столько из-за преимуществ самой криопексии, сколько из-за недостатков диатермокоагуляционного воздействия. Однако использование диатермии показано в 4-х случаях: 1 — при тонкой склере; 2 — при наличии «субатрофичной» сосудистой оболочки и слабо пигментированного глазного дна; 3 — для коагуляции дна «кармана» при интрасклеральном пломбировании; 4 — при отсутствии аппарата для криокоагуляции. При использовании диатермокоагуляции следует помнить, что недостаточная коагуляция—меньшее зло, чем избыточное ее воздействие. Недостаток слипчивого воспаления между хориоидеей и сетчаткой, а точнее между слоями сетчатки, т.е. пигментным эпителием и слоем нейрорецепторов, можно исправить в послеоперационном периоде добавочной фото- или лазеркоагуляцией. В отличие от лазер- или фотокоагуляции диатермическое воздействие труднее дозировать. Кроме того, последствием передозировки является, как правило, массивная послеоперационная ретракция стекловидного тела, резко ухудшающая прогноз. Поэтому использование только диатермокоагуляции в целях лечения отслойки сетчатки является неоправданно рискованным вмешательством. Интенсивность аппликаций наконечника диатермокоагулятора можно оценить по внешнему виду склеры и картине глазного дна. На склере должно образоваться серое или коричневое пятно, чуть больше, чем участок контакта с электродом. На глазном дне через несколько минут можно увидеть серовато-белые очаги диаметром приблизительно 1/3—1/4 диска зрительного нерва. Следует помнить, что интенсивность прижигания в случае тяжелых отслоек можно несколько увеличить, но не за счет числа коагуляций. Расстояние между коагулятами во избежание некроза должно быть не менее 2 мм. Наиболее употребимые аппараты для диатермокоагуляции — отечественные ДК-1, ДК-3.
Применение криопексии предпочтительнее из-за следующих соображений: 1 — воздействие холода дает в конечном итоге более нежные рубцы, причем спаяние в большей степени интраретинальное, а не хориоретинальное как при диатермокоагуляции, и степень слипчивого воспаления сравнительно легко дозируется интенсивностью криоаппликаций — при условии, что в процессе криовоздействия промораживаются все оболочки до сетчатки (23,24,106); 2 — криопексия может быть применена через конъюнктиву или транссклерально; 3 — незначительное повреждение склеры и уменьшение возможности инфекции в послеоперационном периоде, связанной с некрозом склеры; 4 — криопексия практически не повреждает большие сосуды (вортикозные вены, длинные цилиарные артерии) и снижает риск ишемии переднего отрезка глаза; 5 — криокоагуляция в меньшей степени повреждает корковые слои стекловидного тела и сетчатку, что на практике выражается в снижении частоты возникновения макулярного фиброза в послеоперационном периоде.
Применение криопексии целесообразно в 4 случаях: 1 — при толстой плохо просушиваемой склере; 2 — с целью профилактического лечения дегенеративных изменений сетчатки, расположенных впереди от экватора; 3 — в случаях чрезмерно истонченной или некротически измененной склеры после предыдущих операций; 4 — при локализации разрывов в местах прохождения длинных цилиарных артерий, при расположении разрывов в центральной зоне сетчатки. Интенсивность криокоагуляции зависит от применяемой температуры, длительности аппликации, толщины склеры, выраженности васкуляризации, высоты отслоения сетчатки.
Самым простым способом криокоагуляции является использование кусочков сухого льда, а также применение отечественных поршневых криоэкстракторов со специальными уплощенными наконечниками. Наиболее точно можно дозировать криокоагуляцию с помощью офтальмоскопического контроля. Криозонд должен быть покрыт резиновым чехлом во избежание примораживания век и конъюнктивы (лучше использовать отрезок силиконовой трубки просветом 2,5-3 мм). Криокоагуляцию следует проводить до появления беловатого очага на глазном дне в месте приложения криозонда. Во время криовоздействия зондом производят вдавление оболочек в месте разрыва и при соприкосновении вала вдавления с сетчаткой криопексию прекращают при появлении беловатого очага с нечеткими контурами на сетчатке. В случае наличия высокого пузыря отслойки вал вдавления, как правило, не достает до ретины и окончание криопексии производят при появлении серовато-белого слабого очага под отслоенной сетчаткой. Криотерапии подвергают область вокруг разрыва сетчатки и обычно нет необходимости криокоагуляции сетчатки на всем протяжении предполагаемого пломбирования. Примораживание участков сетчатки, подозрительных на разрывы, (решетчатая дегенерация, дегенерация типа «следа улитки») может помочь их выявлению. Имеющиеся разрывы хорошо выделяются на белом фоне примороженной сетчатки. При затрудненной офтальмоскопии (недостаточно широкий зрачок, полупрозрачный хрусталик, помутнения в стекловидном теле) время криоаппликаций сухим углекислым льдом или криоаппликатором ориентировочно составляет 12-15 сек. (7-10 сек. при плоской отслойке). При использовании криоаппликатора с жидким азотом экспозиция обычно составляет 2-3 сек. При гигантских разрывах и отрывах криокоагуляцию следует проводить по всему заднему краю разрыва и отступя от него на 1-2 мм к центру для исключения подтекания СРЖ в послеоперационном периоде.
Из возможных осложнений криопексии следует отметить примораживание век и конъюнктивы, которые в послеоперационном периоде могут дать сильнейший отек и хемоз. Местное применение кортикостероидов обычно приводит к исчезновению этих явлений в течение 7-10 дней. Замораживание криозондом с вдавлением в области крупных сосудов (в особенности в области ампул вортикозных вен) может привести к значительным кровоизлияниям в стекловидное тело и хориоидею. Обычно незначительное количество крови в стекловидном теле подвергается рассасыванию в ближайшие 2-3 недели. Остановка кровотечения во время операции осуществляется путем компрессии глаза и вызыванием повышения ВГД и, таким образом, тампонирования поврежденного сосуда. Целесообразно внутривенное введение дицинона, а в послеоперационном периоде рассасывающей терапии. При интенсивном примораживании наконечника к склере может произойти повреждение наружных сосудов и даже разрыв склеры при попытке ускорить выведение зонда, не дожидаясь полного оттаивания его от окружающих тканей. Сравнительно редки случаи серозной хориоидальной отслойки после примораживания значительных площадей или увеличения продолжительности его. На операционном столе офтальмоскопически отмечаются пузыревидные отслойки сосудистой, которые, как правило, не мешают дальнейшему ходу операции и подвергаются обратному развитию в ближайшие 2-4 дня. При чрезмерной или повторной криокоагуляции в одних и тех же точках может произойти выброс значительного количества пигмента из клеток пигментного эпителия, который, выходя из разрушенных клеток пигментного эпителия, попадет в стекловидное тело или под сетчатку, собираясь в глыбки в макулярной области или в области диска зрительного нерва в первые послеоперационные дни, когда пациент находится на постельном режиме. Выброс пигмента и отложение его в макулярной зоне и в области зрительного нерва может служить причиной небольшого понижения зрения в первые послеоперационные дни и значительного понижения зрения вследствие развития макулярного фиброза спустя 2-4 мес. после операции (45,70,10,7,125,129,144,183).
Фото- и лазеркоагуляция как самостоятельные методы лечения ограничены случаями с периферическими и центральными разрывами после постельного режима. Кроме того, воздействие фотокоагулятором и лазером (например, фотокоагулятор фирмы «ОПТОМ», «Карл Цейс» или аргоновый лазер типа «Когерент радиейшен») показано для профилактического лечения дегенеративных изменений сетчатки, «немых» разрывов и т.д., а также для дополнительного блокирования больших и гигантских разрывов после операции пломбирования склеры с циркляжем. Следует подчеркнуть, что фото- и лазеркоагуляция могут применяться только при полном прилегании сетчатки в области разрыва (биомикроскопический контроль!). При этом воздействие аргоновым лазером, предпочтительнее фотокоагуляции из-за меньшего термического повреждения стекловидного тела, в особенности его коркового слоя и внутренней пограничной мембраны, приводящего к их сморщиванию и возникновению фиксированных складок сетчатки и макулярного фиброза. Мощность лазерного импульса обычно составляет 0,2-0,4 дж. Длительность экспозиции — 2-3 мс, диаметр фокуса — 150-200 микрон. Начинать следует с минимальной дозы, при необходимости увеличивая ее. Правильные дозировки определяются по возникновению на сетчатке беловатого ватообразного очажка без кровоизлияний. Остановившись на этой дозировке, производят ограничение разрыва одним или двумя рядами коагулятов в шахматном порядке.
При макулярных разрывах должен щадиться по мере возможности папилломакулярный пучок, и поэтому коагуляты ставят в виде подковы, обращенной вогнутой стороной к зрительному нерву. Однако допустимо нанесение коагулятов диаметром 50 микрон по самому краю разрыва циркулярно по всему периметру (рис.42). Лазерную коагуляцию, особенно при периферических разрывах, лучше всего производить с
|
Рис.42. Ограничение макулярного разрыва с помощью лазеркоагуляции
помощью гониоскопа Гольдмана. Очень удобно также при определенном навыке применять для этих целей лупу +60— +80 ОД перископического типа по методике М. М. Краснова.
Вызывание слипчивого хориоретинального воспаления низкочастотным ультразвуком требует пока дальнейшего уточнения показаний и большего числа наблюдений. Преимущества этой методики, описываемые авторами (М.М.Краснов, И.Н.Субботина), заключаются в отсутствии повреждений склеры, возможности проведения на влажном операционном поле, малой травматичности для коркового слоя стекловидного тела. Нельзя не отметить тот факт, что в последние годы значение термической стимуляции слипчивого воспаления между хориоидеей и сетчаткой для прилегания отслоенной сетчатки ставится под сомнение. Рядом исследований (61,105,207) доказана возможность образования хориоретинальной спайки только за счет имплантации пломбирующих материалов. Она вызывает асептический воспалительный процесс в окружающих тканях. Образующаяся бескоагуляционная хориоретинальная спайка не уступает по механической прочности коагуляционной: в области вдавливающего пломбирования спайка сетчатки с пигментным эпителием настолько прочна, что после лабораторной обработки препаратов в случае механического повреждения сетчатки отрыв происходит в области слоев сетчатки, но не от пигментного эпителия. Кроме того, из всех известных методик вызывания хориоретинальной спайки лишь при бескоагуляционной спайке происходит восстановление нормального строения оболочек глаза в зоне вмешательства.
Важной задачей предоперационного периода является выбор материала для пломбирования склеры — операции, которая представляет собой экстрасклеральное или интрасклеральное вдавление оболочек с помощью синтетических или биологических материалов.
Из биологических материалов в качестве пломб чаще всего используется консервированная гомосклера, твердая мозговая оболочка, гомохрящ (14,32,41,42,75,80). Применение гомосклеры обычно вызывает минимальную реакцию со стороны тканей глаза. Пластичность ее позволяет приготовлять пломбы любой толщины путем заворачивания полоски склеры. Консервацию гомосклеры или гомохряща проводят в 70% спирте. За полчаса до операции нужный кусочек гомосклеры или хряща опускается в 30% раствор альбуцида или физиологический раствор с антибиотиками. Консервированная твердая мозговая оболочка хорошо переносится тканями глаза, но большая мягкость ее и эластичность не позволяет создать надежный вал вдавления при высоких пузырях отслойки. Однако она может заменять гомосклеру при ее отсутствии. Материалом наиболее близким к идеальному по своей переносимости и пластичности несомненно является аутохрящ (32,42). Обычно используется ушной аутохрящ. Недостатком метода является дополнительная травматизация пациента и ограниченность материала в особенности при необходимости пломбирования больших размеров. Второго недостатка лишен метод пломбирования с использованием ахиллова сухожилия (41,42), однако травматизация важного в функциональном отношении органа ограничивает широкое распространение этого метода.
Использование силиконовой резины в качестве материала для вдавления оболочек глаза наряду с применением бинокулярного офтальмоскопа и криопексии резко повысило эффективность хирургического лечения отслойки сетчатки. Преимуществами силиконовых имплантатов являются их эластичность, простота стерилизации, нетоксичность, отсутствие антигенных свойств, легкость моделирования во время операции (53,100,106). Преимущества силиконовых имплантатов перед всеми остальными стали наиболее очевидны после введения Lincoff (100,153,204) губчатых материалов (силиконовые губки). Эластичность губок практически исключает некроз склеры и даже в случаях выраженного вдавления наблюдается незначительное истончение склеры. Возможность подшивания губки к склере расширили выбор хирургических приемов при различных видах отслойки. К примеру, использование силиконовых губок позволило несколько расширить показания к бездренажному способу лечения отслоек. В этих случаях эластичность губки позволяла постепенно увеличивать высоту вала вдавления в первые послеоперационные часы и достигать сближения оболочек. Губки легко моделируются, хорошо переносятся глазом. Стерилизация силиконовых пломб может проводиться методом автоклавирования, кипячения, а также используя сухожаровые стерилизаторы. Основными недостатками силиконовых имплантатов являются возможность отторжения после прорезания швов через 3-5 мес. после операции и уменьшения таким образом высоты вала вдавления. Некоторые авторы сообщают о 3-5% отторжений силиконовых имплантатов в первые месяцы после операции, что, однако, редко вызывало рецидив отслойки сетчатки (131,184). При использовании губчатых силиконовых имплантатов описаны случаи инфицирования их и отторжения (106,147,193).
Виды силиконовых имплантатов.Основным производителем силиконовых имплантатов на Западе была фирма «MJRA» США, которая выпускала большой набор эластичных лент, губчатых и негубчатых пломб.
С 1983 г. отечественной промышленностью выпускается серийно комплекты имплантатов эластичных для склеропластических операций (ИСЭСО). Силиконовые имплантаты изготавливаются в виде лент для циркляжа (ИЛ-2,5 и ИЛ-4,0); капилляров соединительных ИЭК-0,7 и ИЭК-0,9. Кроме того, в комплекты входят пломбы-шины с закрытым каналом для проведения циркляжного элемента (ИЭШЗ-10 и ИЭШЗ-14) и силиконовые диски, из которых при желании можно вырезать пломбу любой конфигурации в зависимости от сложности случая. В набор входит также пластинка из силиконовой резины для различных комбинированных операций с использованием тонких прокладок и для закрытия дефектов склеры. В наборе выпускаются и губчатые силиконовые материалы в виде пористых жгутов диаметром 6 и 4 мм (ИЭЖ-6и ИЭЖ-4) (рис.43). Выпускаемые силиконовые имплантаты выдерживают не менее 5 циклов стерилизации воздушным методом (1
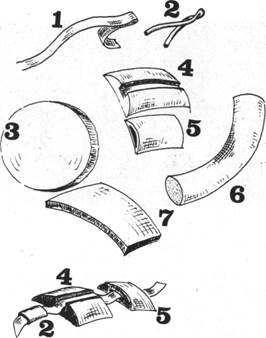
Рис.43. Набор силиконовых имплантатов.
цикл стерилизации: 60 мин. при 180°С по ОСТ 4242-2-77). Следует отметить, что силиконовые имплантаты, хотя и являются общепризнанными и широко применяемыми материалами, не исключают использование и поисковых материалов для пломбирования. Отдельные хирурги (42,106,177) предпочитают применять склеральные карманы с заполнением их желатиной, кусочками сухожилия или гелевыми имплантатами. Представляет интерес также использование (65) коллагеноподобных субстанций. По данным авторов, разработанный ими биологический рассасывающийся пломбирующий материал — ксенодерма, удобен для использования, мягкий и эластичный, допускающий возможность моделирования пломб необходимых форм и размеров, легко стеоилизуемый g-облучением, без ухудшения его биологических и механических свойств. Ксенодерма выгодно отличается от примеряемых биологических пломбирующих материалов возможностью создания надежного вала вдавления в течение практически любого заданного промежутка времени путем регулирования скорости лизиса ксенодермы в организме. В зависимости от степени обработки время рассасывания можно регулировать от 2-3 месяцев до 1,5 лет (рис.44).

Рис.44.Внешний вид пломб из ксенодермы
Выбор способа операции.В арсенале способов сближения сетчатки и хориоидеи исторически насчитываются десятки приемов. Все они могут быть сведены к 4 основным группам: 1) пункция субретинальной жидкости с последующим постельным режимом (58,80,101,122); 2) вдавление оболочек с эвакуацией жидкости (104,139,192); 3) вдавление оболочек без пункции (145,152,203); 4) приближение сетчатки к хориоидее со стороны стекловидного тела (эндовитреальные вмешательства с введением воздуха, физраствора, гелевых или пластмассовых имплантатов (11,17,19,21, 101,108,118,123,194).
При выборе наиболее рационального способа следует придерживаться четкого разделения всех отслоек сетчатки по степени их тяжести При полном прилегании отслойки после постельного режима наиболее эффективна и безопасна фото- или лазеркоагуляция в зоне разрыва, как крайний вариант можно использовать криопексию в зоне разрыва трансконъюнктивально или после разреза конъюнктивы в одном из квадрантов. Подавляющее большинство отслоек сетчатки в случае неполного прилегания после постельного режима подлежат хирургическому лечению с вдавлением оболочек в области разрыва с помощью пломбы. Основная идея склерального пломбирования - закрыть разрыв сетчатки сближая пигментный эпителий с отслоенной частью сетчатки в зоне разрыва. Однако это слишком упрощенное объяснение механизма склерального пломбирования. В механизме прилегания играют также роль уменьшение объема глаза, снижение динамической или статической тракции стекловидного тела, не исключена также

возможность «внутреннего» пломбирования, т.е. сближения сетчатки в зоне разрыва с корковым слоем стекловидного тела, имеющего малую проницаемость для жидкостей.
При I-II категориях тяжести отслоек наиболее подходящая операция локального пломбирования без выпускания СРЖ. При использовании бездренажной процедуры с локальным пломбированием следует рассмотреть несколько вариантов техники операции: 1. проводить пломбирование экстрасклерально или интрасклерально, выкраивая специальный карман (рис.45); 2. величину пломбы; 3.направление вала вдавления (радиально или параллельно лимбу).
Специальный хирургический инструментарий и материал включает в себя непрямой или прямой офтальмоскоп, склерокомпрессор, который может быть заменен обыкновенным мышечным крючком, держатель бритвенного лезвия, скарификатор Демарра или круглый нож, ретрактор, локализационный пинцет или специальная игла с загнутым кончиком, капроновые или супрамидные швы на атравматической игле 7-9 мм, 4-0,5-0, например венгерской фирмы «МЕДИКОР», циркуль-измеритель, аппарат для криопексии.
Пломбирование в интрасклеральном кармане может производиться только при толстой склере, не поврежденной предыдущими операциями и коагуляцией. Вид интрасклерального кармана выбирается в зависимости от локализации величины и типа разрыва Чаще употребляется выкраивание окончатого кармана (рис.46)
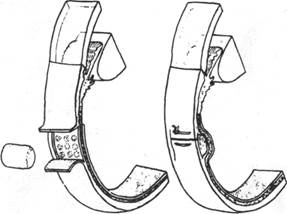
Рис.46.Схема выкраивания окончатого интрасклерального кармана (по Линкофф)
Надрез склеры на 1/2-2/3 толщины производится осколком бритвенного лезвия, ножом Грефе или круглым ножом — в зависимости от навыков хирурга. Расслаивание лучше всего производить круглым ножом или скарификатором Демарра. Интрасклеральный карман по ширине должен превосходить разрыв примерно на 30°. Глубина кармана, т.е. протяженность к заднему полюсу обычно составляет 8-10 мм, а при множественных разрывах в одном квадранте до 12 мм. Проекция разрыва должна находиться в центре образованного кармана. Этим достигается равномерное вдавление оболочек в области разрыва, уменьшается опасность образования меридианальных складок, возникновения формы разрыва «рыбья пасть» и подтекания жидкости в субретинальное пространство. Встречающиеся вортикозные вены должны максимально щадиться. Этого можно достигнуть с помощью выкраивания П-образного кармана для имплантата (при разрывах, располагающихся под ампулой вортикозной вены), а также техникой интрасклерального расслаивания под вортикозной веной (рис.47).
Рис.47. Техника выкраивания интрасклерального кармана при локализации разрыва сетчатки в области ампулы вортикозной вены
Вортикозной веной можно пожертвовать только при локализации крупного разрыва в месте ее проекции. Достигается это путем перевязки ее после предварительного тщательного выделения и диатермокоагуляции,отступая от ампулы на 3-4 мм.
На наш взгляд, более безопасным, простым и доступным даже для начинающего хирурга является способ экстрасклерального пломбирования. Величина пломбы в этом случае определяется размерами самого разрыва или расстоянием между разрывами в случае их множественности. Вал вдавления должен быть шире зоны разрыва на 1,5-2 мм. При высоком пузыре отслоения и трудности создания контакта между валом вдавления и разрывом во время операции следует увеличить ширину вала вдавления во избежание возможного смещения его в сторону из-за явления параллакса. Ширина вала вдавления может быть изменена как увеличением размеров самой пломбы (например, диаметра
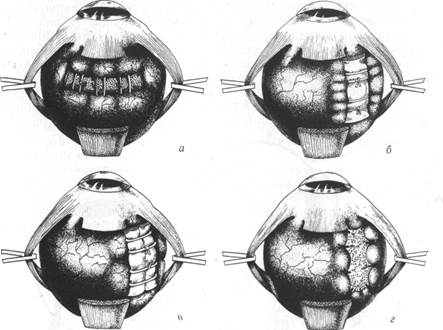 Рис.48. Схема сегментарного пломбирования силиконовой губкой: а)—с помощью П-образных швов; б)—схема радиального пломбирования одной и в)—двумя силиконовыми губками; г)—«аппланирующее» пломбирование.
жгута силиконовой губки)., так и совмещением 2-х и более пломб, а также растягиванием швами сегмента силиконовой губки по склере — «аппланирующее» пломбирование (рис.48,а,б,в,г). Вал вдавления шириной 8 мм в области экватора может закрыть разрыв величиной примерно в 40° (102,114). Ширина вала вдавления обычно определяется как размерами пломбы, так и местом вкола и выкола П-образных швов и силой их натяжения при завязывании. Сила натяжения, в свою очередь, обусловливает степень повышения ВГД в особенности при операции без выпускания СРЖ. Основной критерий избыточности натяжения является обнаружение систолической пульсации центральной артерии сетчатки при офтальмоскопическом контроле за диском зрительного нерва. Естественно, при операции вдавления с выпусканием жидкости имеется опасность впадения в другую крайность — чрезмерного перетягивания швов и, таким образом, увеличения высоты вала вдавления. В среднем, расстояние между вколом и выколом П-образных швов должно примерно превышать ширину пломбы в 1,5 раза. Пломбирование склеры обычно осуществляется или радиально или циркулярно, т.е. параллельно лимбу. Выбор направления пломбирования обычно зависит от многих факторов, в которые следует включить форму разрыва (круглый или клапанный), величину, количество разрывов и их расположение относительно друг друга, степень удаленности разрыва от лимба (отрывы, преэкваториальные разрывы, экваториальные, парацентральные, центральные). В некоторых случаях, например при комбинациях клапанного разрыва с мелкими дырчатыми, расположенными на одном или разных уровнях, может использоваться сочетание радиальной пломбы с сегментарной параллельно лимбу (рис.49а,б). Вдавление
Рис.48. Схема сегментарного пломбирования силиконовой губкой: а)—с помощью П-образных швов; б)—схема радиального пломбирования одной и в)—двумя силиконовыми губками; г)—«аппланирующее» пломбирование.
жгута силиконовой губки)., так и совмещением 2-х и более пломб, а также растягиванием швами сегмента силиконовой губки по склере — «аппланирующее» пломбирование (рис.48,а,б,в,г). Вал вдавления шириной 8 мм в области экватора может закрыть разрыв величиной примерно в 40° (102,114). Ширина вала вдавления обычно определяется как размерами пломбы, так и местом вкола и выкола П-образных швов и силой их натяжения при завязывании. Сила натяжения, в свою очередь, обусловливает степень повышения ВГД в особенности при операции без выпускания СРЖ. Основной критерий избыточности натяжения является обнаружение систолической пульсации центральной артерии сетчатки при офтальмоскопическом контроле за диском зрительного нерва. Естественно, при операции вдавления с выпусканием жидкости имеется опасность впадения в другую крайность — чрезмерного перетягивания швов и, таким образом, увеличения высоты вала вдавления. В среднем, расстояние между вколом и выколом П-образных швов должно примерно превышать ширину пломбы в 1,5 раза. Пломбирование склеры обычно осуществляется или радиально или циркулярно, т.е. параллельно лимбу. Выбор направления пломбирования обычно зависит от многих факторов, в которые следует включить форму разрыва (круглый или клапанный), величину, количество разрывов и их расположение относительно друг друга, степень удаленности разрыва от лимба (отрывы, преэкваториальные разрывы, экваториальные, парацентральные, центральные). В некоторых случаях, например при комбинациях клапанного разрыва с мелкими дырчатыми, расположенными на одном или разных уровнях, может использоваться сочетание радиальной пломбы с сегментарной параллельно лимбу (рис.49а,б). Вдавление
|
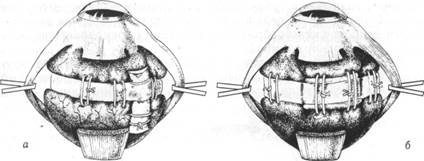
Рис.49.Комбинация циркулярного вдавления оболочек глаза силиконовой лентой с радиальным пломбированием (а) и с пломбированием параллельно лимбу (б)
|
|
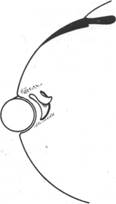
Рис.49в. Эффект влияния пломбирования при совпадении вала вдавления с центральным краем разрыва: 1—при расположении пломбы параллельно лимбу; 2 - при радиальном расположении (по Линкоф)
параллельно лимбу предпочтительнее при сочетании множественных разрывов в одном или двух квадрантах, при отрывах, разрывах по величине, превосходящих 40—45°. Однако при клапанном разрыве сегментарная пломба при совпадении вала вдавления с центральным краем разрыва может привести к увеличению зияния клапана и возникновению разрыва, известного под названием «рыбья пасть». В этих случаях более эффективными оказываются радиальные пломбы (рис.49в), которые лучше блокируют центральный край, в особенности при разрывах, расположенных за экватором. Судя по данным литературы (102,171,186), радиальное пломбирование используется примерно в 45% случаев операций по поводу отслойки сетчатки. Область применения их ограничивается клапанными разрывами типа «подковы», щелевидными типа «рыбья пасть», средними и крупными разрывами, расположенными за экватором, мелкими одиночными разрывами, при сочетании разрыва с радиальными складками. При сочетании мелких разрывов по периферии с одиночным разрывом за экватором наиболее целесообразна комбинация циркулярного вдавления с радиальной пломбой.
Особое место среди способов пломбирования занимает круговое вдавление, или так называемый циркляж (рис.50), который появился исторически позже локального пломбирования и был введен в практику
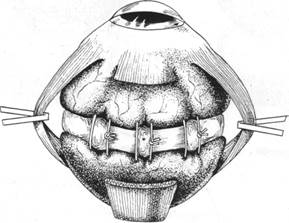
Рис.50. Схема кругового вдавливающего пломбирования
двумя выдающимися офтальмологами (Скепенсом — вдавление полиэтиленовой трубкой — 1954 г. и Арруга - с использованием циркулярного шва на склеру— 1958 г.). Методика сначала была разработана для блокирования множественных разрывов в различных квадрантах, а также при необнаружении разрывов. Операция стала очень популярна не только из-за способности закрывать множественные разрывы, но из-за легкости выполнения и обоснованности с точки зрения биомеханики глаза. Вдавление на 360°, во-первых, уменьшает тракцию со стороны стекловидного тела в плоскости вдавления за счет уменьшения диаметра глазного яблока в этом месте. Во-вторых, по существующей теоретической предпосылке создается как бы дополнительная зубчатая линия, предохраняющая от дальнейшего появления разрывов в этой области и служащая профилактическим барьером для распространения отслойки. Циркляж показан в следующих случаях: 1) при наличии множественных разрывов (по данным разных авторов, множественные разрывы при отслойках сетчатки встречаются в 37—43% случаев (75,106); 2) при необнаружении разрывов, при тотальных отслойках сетчатки, когда по конфигурации отслойки трудно предсказать локализацию дефекта; 3) при неудаче локального пломбирования, где имеется подозрение на существование скрытого разрыва вне зоны вдавления; 4) при афакии, когда риск необнаружения мелких разрывов в преоральной зоне очень велик; 5) при наличии статической витреальной тракции с целью снижения ее путем уменьшения диаметра глазного яблока в плоскости тракции; 6) в случаях гигантских разрывов, при которых требуется циркулярное вдавление; 7) при истонченной стафиломатозной склере, препятствующей надежному укреплению эписклерального или внутрисклерального имплантата; 8) как дополнительный поддерживающий элемент для эписклеральных пломб при множественных разрывах и тонкой склере.
Дата добавления: 2015-06-12; просмотров: 1649;
