Количество тепла Q, которое необходимо сообщить жидкости для испарения единицы её массы при постоянной температуре, называется удельной теплотой парообразования r.
Количество теплоты, которое надо затратить, чтобы перевести в пар жидкость массой m,
Q = r·m. (5.1)
В результате хаотического движения над поверхностью жидкости молекула пара, попадая в сферу действия молекулярных сил, вновь возвращается в жидкость. Этот процесс называется конденсацией. При конденсации тепло возвращается обратно.
Испарение жидкости происходит при любой температуре и тем быстрее, чем выше температура, больше площадь свободной поверхности испаряющейся жидкости и быстрее удаляются образовавшиеся над жидкостью пары.
5.2. Насыщенные и ненасыщенные пары
Если за одно и то же время число испаряющихся и конденсирующихся молекул пара одинаково, то число молекул пара над жидкостью будет оставаться постоянным. Такое состояние называют динамическим равновесием пара и жидкости.Пар, находящийся в динамическом равновесии с жидкостью, называют насыщенным. Давление, при котором наблюдается равновесие между жидкостью и паром, называется давлением насыщенного пара.При неизменной температуре плотность насыщающего пара над жидкостью остается постоянной.
Пар, плотность которого меньше плотности насыщающего пара при той же температуре, называют ненасыщенным. Ненасыщенный пар подчиняется законам идеального газа.
Частным случаем испарения является кипение.Это процесс интенсивного парообразования не только со свободной поверхности, но и в объеме жидкости. В объеме образуются пузыри, заполненные насыщенным паром. Они поднимаются вверх под действием выталкивающей силы и разрываются на поверхности. Центрами их образования являются мельчайшие пузырьки посторонних газов или частиц различных примесей.
Процесс превращения жидкости в пар требует затрат энергии на разрыв связей между молекулами жидкости и на работу против сил внешнего давления. Давление насыщенного пара Pнас внутри пузырька, находящегося у поверхности жидкости, равно сумме внешнего давления на жидкость Рвн и давления под искривленной поверхностью жидкости.
Рнас= Рвн+ 2σ/r , (5.2)
где r - радиус пузырька, σ - коэффициент поверхностного натяжения.
Если пузырек имеет размеры порядка нескольких миллиметров и более, то вторым слагаемым можно пренебречь и, следовательно, для больших пузырьков при неизменном внешнем давлении жидкость закипает, когда давление насыщенного пара в пузырьках становится равным внешнему давлению.
При повышении температуры равновесие между жидкостью и паром нарушается и в течение некоторого времени поток молекул в направлении из жидкости в пар будет больше чем в направлении пар - жидкость. Затем равновесие восстановится, но при другом давлении. Зависимость давления насыщенного пара от температуры представлена на рис. 5.1. Тр – тройная точка, Ткр и Ркр – температура и давление в критической точке, которая будет обсуждаться ниже.
Всё сказанное о равновесии между жидкостью и паром справедливо и для системы твёрдое тело – газ.
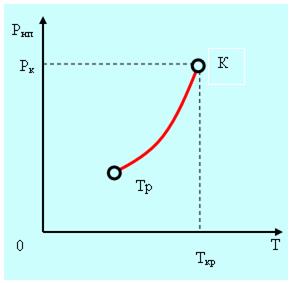
Рис. 5.1.
5.3. Равновесие жидкости и насыщенного пара
Если сжимать реальный газ при постоянной температуре, то по достижении некоторого значения объёма Vг давление перестанет увеличиваться, а вещество становится неоднородным, так как часть газа конденсируется в жидкость. Если и дальше уменьшать объём, то всё большее количество вещества переходит в жидкое состояние, причём давление остаётся постоянным и равным давлению насыщенного пара Рнп. После того как весь пар превратится в жидкость в точке Vж, давление начинает расти очень быстро, так как жидкость – плохо сжимаемая фаза (рис. 5.2).
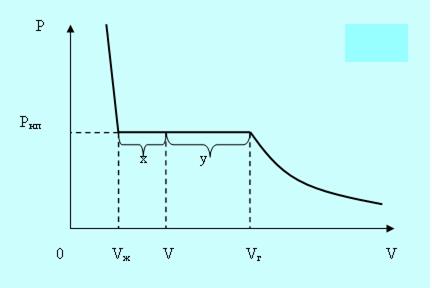
Рис. 5.2.
При любом промежуточном значении объёма V часть вещества будет находится в жидком состоянии mж, а часть в парообразном mп. Найдём отношение mж/ mп.
Величина V’ называется удельным объёмом единицы массы вещества. Удельные объёмы насыщенного пара и жидкости при давлении Рнп равны:

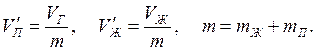 (5.3)
(5.3)
В промежуточном состоянии на долю жидкости будет приходиться объём V’жmж и аналогично на долю пара будет приходиться объём - Vпmп (из определения удельного объёма). Вместе они должны быть равны объёму системы в этом промежуточном состоянии:
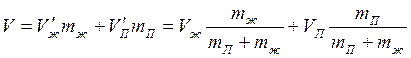 . (5.4)
. (5.4)
Отсюда
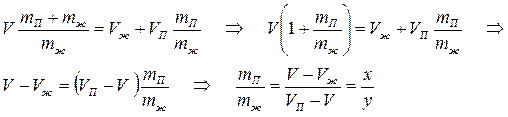 (5.5)
(5.5)
Этот результат справедлив для любых двух фазных состояний, в том числе и для двух кристаллических модификаций одного и того же вещества:
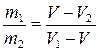 . (5.6)
. (5.6)
5.4. Влажность.
Для того чтобы судить, много или мало водяных паров находится в воздухе, вводят понятие влажности. Абсолютная влажность - количество пара, выраженное в килограммах, содержащееся в 1 м3 при данной температуре, т.е. абсолютная влажность равна плотности паров воды.
Относительная влажность В - это отношение абсолютной влажности к плотности насыщенного пара при данной температуре.
В = 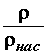 100% . (5.7)
100% . (5.7)
Плотность насыщенного водяного пара при данной температуре есть величина табличная. Для определения относительной влажности надо знать абсолютную влажность, которую можно определить по точке росы.
Дата добавления: 2015-06-10; просмотров: 2406;
