Общая характеристика ионных насосов. Опыт Уисинга.
Ионные насосы (помпы) – интегральные белки, которые обеспечивают активный перенос ионов против градиента концентрации. Энергией для транспорта служит энергия гидролиза АТФ. Различают Na+/K+ помпу (откачивает из клетки Na+ в обмен на К+), Ca2+ помпу (откачивает из клетки Ca2+), Cl– помпу (откачивает из клетки Cl–) и Н+ помпу.
В результате работы ионных насосов создаются и поддерживаются трансмембранные ионные градиенты:
• концентрация Na+, Ca2+, Cl– внутри клетки ниже, чем снаружи (в межклеточной жидкости);
• концентрация K+ внутри клетки выше, чем снаружи.
Активный транспорт веществ через биологические мембраны имеет огромное значение. За счет активного транспорта в организме создаются разности концентраций, разности электрических потенциалов, давления, поддерживающие жизненные процессы, то есть с точки зрения термодинамики активный перенос удерживает организм в неравновесном состоянии, поддерживает жизнь, так как равновесие – это смерть организма. Существование активного транспорта веществ через биологические мембраны впервые было доказано в опытах Усинга (1949 год) на примере переноса ионов натрия через кожу лягушки (рис. 8).
Экспериментальная камера Усинга, заполненная нормальным раствором Рингера, была разделена на две части свежеизолированной кожей лягушки. В опыте исследовали однонаправленные потоки ионов натрия через кожу лягушки в прямом и обратном направлениях.

 На изолированной коже лягушки, разделяющей раствор Рингера, возникает разность потенциалов φвн – φнар (внутренняя сторона кожи положительна по отношению к наружной). В установке имелось специальное устройство: электрическая батарея с потенциометром – делителем напряжения, с помощью которых компенсировалась разность потенциалов на коже лягушки: Δφ= φвн – φнар = 0, что контролировалось вольтметром. Кроме того, концентрация ионов натрия с внешней и внутренней сторон поддерживалась одинаковой.
На изолированной коже лягушки, разделяющей раствор Рингера, возникает разность потенциалов φвн – φнар (внутренняя сторона кожи положительна по отношению к наружной). В установке имелось специальное устройство: электрическая батарея с потенциометром – делителем напряжения, с помощью которых компенсировалась разность потенциалов на коже лягушки: Δφ= φвн – φнар = 0, что контролировалось вольтметром. Кроме того, концентрация ионов натрия с внешней и внутренней сторон поддерживалась одинаковой.
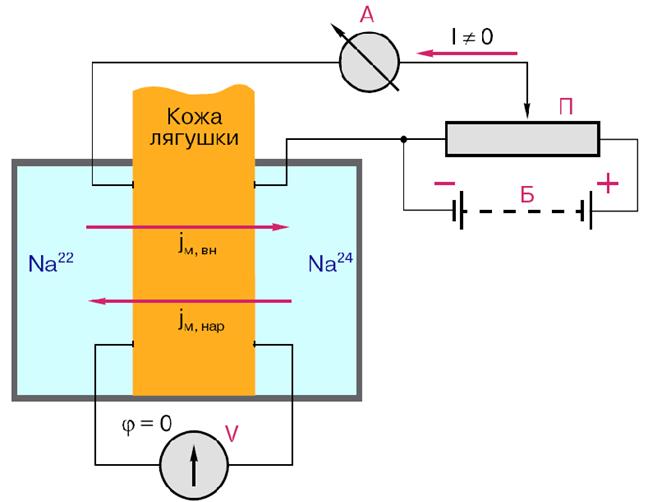
Рис. 8. Схема опыта Уисинга на коже лягушки. V – вольтметр для измерения разности потенциалов на коже лягушки, А – амперметр для измерения трансмембранного тока, Б – батарейка, П – потенциометр.
Суммарный поток ионов через мембрану должен был бы отсутствовать. Его наличие свидетельствовало бы о переносе ионов против перепада концентрации, то есть об активном переносе. Для доказательства этого в левую часть экспериментальной камеры были добавлены радиоактивные изотопы 22Na, а в правую – 24Na. 22Na распадается с излучением жестких γ-квантов, излучение 24Na фиксировалось по мягким β-лучам. Было показано, что поток 22Na больше потока 24Na. О наличии тока в цепи свидетельствовали и показания миллиамперметра.
Эти экспериментальные данные неопровержимо свидетельствовали о том, что перенос ионов натрия через кожу лягушки не подчиняется уравнению пассивного транспорта. Более того, оказалось, что суммарный поток ионов натрия исключительно чувствителен к факторам, влияющим на энергетический обмен в клетках кожи: наличию кислорода, действию разобщителей окислительного фосфорилирования, действию низких температур. Следовательно, речь должна идти об особом способе переноса ионов, названном впоследствии активным. Позднее было установлено, что активный перенос ионов натрия в коже лягушки обеспечивается ионными насосами, локализованными в клетках базального эпителия. Работа насоса блокировалась специфическим ингибитором оуабаином.
Дальнейшие исследования показали, что в биологических мембранах имеется несколько разновидностей ионных насосов, работающих за счет свободной энергии гидролиза АТФ, – специальные системы интегральных белков (транспортные АТФазы) (рис. 9). Перенос ионов транспортными АТФазами происходит вследствие сопряжения процессов переноса с химическими реакциями за счет энергии метаболизма клеток.
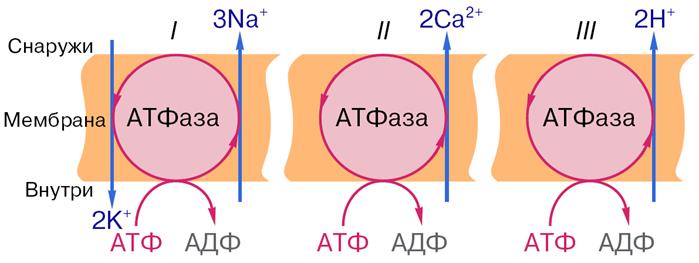
Рис. 9. Активный перенос ионов транспортными АТФазами: I – схема К+-Na+- насоса в клеточной мембране, II – схема кальциевого насоса в мембране саркоплазматического ретикулума, III – схема протонного насоса во внутренней мембране митохондрий.
2.2. Na+/K+-АТФаза
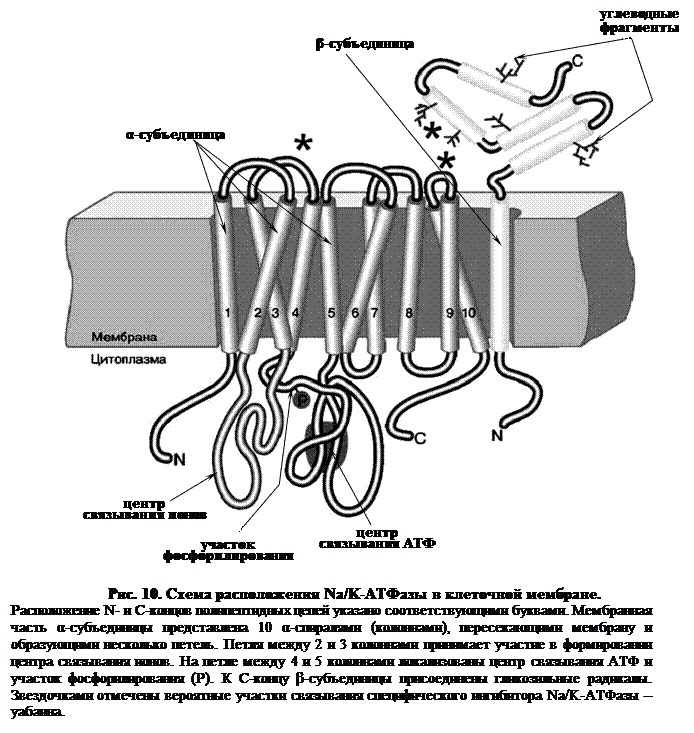
Na/K-АТФаза представляет собой сложный белок, встроенный в наружную мембрану клетки и имеющий центры связывания для ионов натрия и калия, а также активный центр, где осуществляются связывание и гидролиз АТФ (рис. 10).
Функциональная единица фермента состоит из двух полипептидных цепей: большей (α-субъединицы) и меньшей (β-субъединицы), входящих в состав ферментного комплекса в соотношении 1:1. Меньшая субъединица пересекает мембрану только один раз, в то время как большая – много раз, образуя 5 двойных петель, при этом оба конца пептидной цепи обращены в цитоплазму. Активный центр фермента также обращен в цитоплазму и доступен для цитоплазматического АТФ. Центры связывания переносимых ионов локализованы в петле между второй и третьей спиралями, пронизывающими мембрану.
Таким образом, α-субъединица может выполнять функцию насоса независимо от β-субъединицы. Однако оба полипептида образуют компактную глобулу, насквозь пронизывающую мембрану. Та часть β-субъединицы, которая обращена во внеклеточную среду, несет на себе ковалентно присоединенные углеводные фрагменты.
По массе и наличию углеводов этот полипептид можно отнести к лектинам – мембранным гликопротеинам, которые отвечают за межклеточное узнавание и адгезию. В процессе белкового синтеза обе субъединицы встраиваются в мембрану одновременно. Существуют данные, согласно которым β-субъединица обеспечивает правильную ориентацию α-субъединицы в мембране. Гидролизуя АТФ, чтобы обеспечить энергией активный транспорт ионов, Na/K-АТФаза осуществляет сложную многостадийную реакцию, в которой участвуют ионы натрия, калия и магния, а также АТФ. Фермент имеет лабильную структуру. Он легко изменяет свою конформацию (так называют взаимное расположение и упаковку отдельных частей молекулы белка в пространстве) в зависимости от того, какой ион к нему присоединяется.
Уже в ранних исследованиях было показано, что в присутствии натрия фермент легко взаимодействует с АТФ, в результате чего терминальный фосфат АТФ переносится на карбоксил аспарагиновой кислоты белковой цепи, образуя фосфорилированный фермент (Е–Р, где Е обозначает молекулу белка-фермента, а Р – фосфорильный остаток). Фосфофермент является промежуточным продуктом АТФазной реакции. Он может находиться в двух конформационных состояниях, условно обозначаемых как Е1 и Е2. Первая форма обладает повышенным сродством к ионам натрия, а вторая – к ионам калия. Переход между ними сопровождается изменением сродства белковой молекулы к переносимым катионам. В настоящее время цикл Na/K-АТФазы охарактеризован более подробно. Основные стадии можно описать следующим образом (рис. 11).
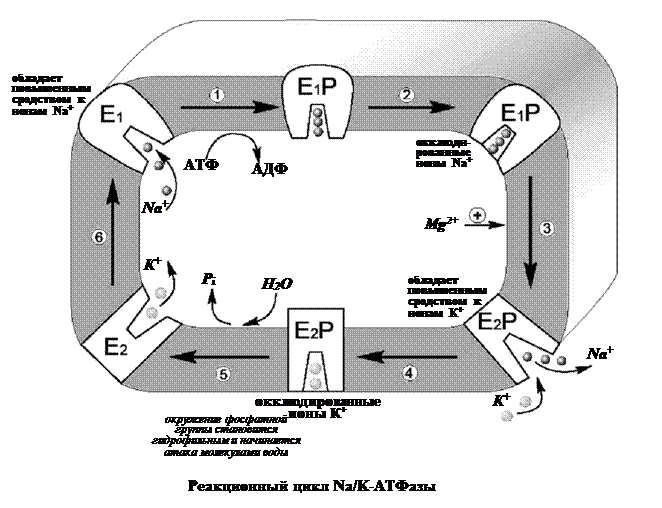
Когда фермент находится в состоянии Е1, он способен взаимодействовать с ионами натрия и АТФ с нутренней стороны мембраны. В результате фосфорилирования молекулы образуется E1P, а АДФ высвобождается из активного центра и возвращается в цитоплазму. Фосфорилированный белок переходит в состояние, при котором ионы натрия не способны высвобождаться ни по внутреннюю, ни по внешнюю стороны мембраны – они недоступны для обмена, окклюдированы. Переход фермента в следующую стадию активируется ионами магния. Хотя специальных центров связывания магния на молекуле фермента не обнаружено, его эффект очень важен – он заключается в ускорении перехода фосфорилированного фермента из конформации E1 в конформацию Е2. Эта стадия отражает молекулярные перемещения отдельных частей белковой глобулы, связанные с непосредственным переносом ионов натрия через мембрану. Таким образом, этот процесс осуществляется синхронно с конформационным переходом E1 – Е2. Вследствие этого окружение центра связывания ионов становится более гидрофобным, и ионы натрия диссоциируют от фермента по другую сторону мембраны, где с этим же центром связываются ионы калия. Калий подвергается такой же окклюзии, что и натрий, и в ходе этого процесса осуществляется перенос ионов калия через мембрану.
Конформационная перестройка, претерпеваемая белком при переходе E1 – Е2, обеспечивает перестройку ионных центров и последующее перемещение петли, содержащей центр связывания ионов, внутрь мембраны. Это приводит к изменению сродства к переносимым ионам и одновременно делает ионный центр доступным для внешней или внутренней среды. Комплекс Е2Р отличается от своего предшественника тем, что окружение фосфатной группировки становится более гидрофильным и фосфат оказывается доступным для атаки молекулой воды. Происходят водный гидролиз Е–Р (дефосфорилирование фосфофермента) и высвобождение неорганического фосфата во внутриклеточную среду. После этого ионы калия также диссоциируют от центра связывания, высвобождаясь в цитоплазму. Последняя стадия цикла одновременно подготавливает фермент для начала нового цикла – конформер Е2 превращается в конформер E1, вновь приобретающий способность взаимодействовать с ионами натрия. Этот процесс ускоряется АТФ, повышающим сродство фермента к натрию и понижающим его сродство к калию.
 Таким образом, за полный гидролитический цикл происходят выброс из клетки трех ионов натрия, обогащение цитоплазмы двумя ионами калия и гидролиз одной молекулы АТФ. Так происходит активный транспорт ионов натрия из клетки и калия в клетку, а энергия АТФ тратится на оплату перехода фермента из одной конформации в другую. Таким образом, в ходе ферментативного процесса перенос ионов натрия и калия осуществляется одним и тем же ионным центром фермента, последовательно изменяющим свое сродство к переносимым ионам при изменении конформации Na/K-АТФазы.
Таким образом, за полный гидролитический цикл происходят выброс из клетки трех ионов натрия, обогащение цитоплазмы двумя ионами калия и гидролиз одной молекулы АТФ. Так происходит активный транспорт ионов натрия из клетки и калия в клетку, а энергия АТФ тратится на оплату перехода фермента из одной конформации в другую. Таким образом, в ходе ферментативного процесса перенос ионов натрия и калия осуществляется одним и тем же ионным центром фермента, последовательно изменяющим свое сродство к переносимым ионам при изменении конформации Na/K-АТФазы.
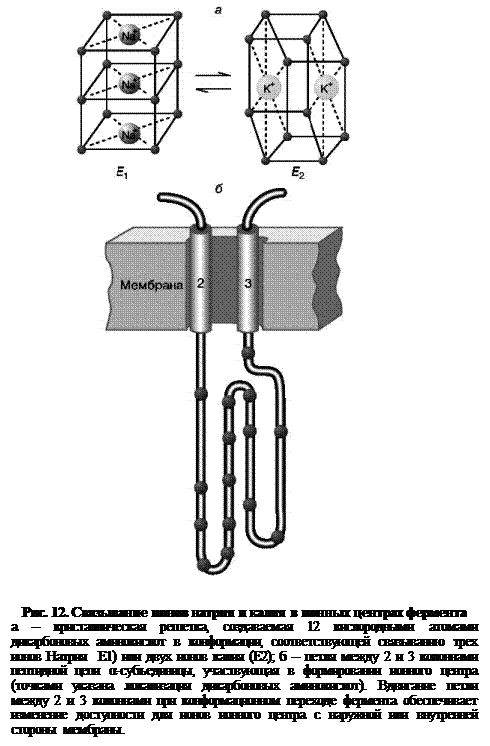
Ионные центры фермента расположены в петле между 2 и 3 α-спиральными участками фермента, пересекающими мембрану. Взаимодействие ионов с этими центрами обеспечивается благодаря координационным связям с атомами кислорода, принадлежащими дикарбоновым аминокислотам белка – аспарагиновой и глутаминовой. В образовании координационных связей с ионами должны принимать участие 12 атомов кислорода карбоксильных групп дикарбоновых аминокислот белка. Точная упаковка этой петли не установлена, однако в ее состав входят 15 дикарбоновых аминокислот, так что выбор групп для образования центра связывания ионов вполне достаточен.
Кислород способен осуществлять координационные взаимодействия с лигандами, образуя решетку одного из двух типов. В одном случае получается рыхлая и доступная для молекул воды структура, а в другом атомы упакованы более плотно и не доступны для гидрофильных группировок. В первом случае ионный центр может связать три иона натрия, а во втором – два иона калия. Этим и объясняется тот факт, что при гидролизе одной молекулы АТФ фермент обменивает три иона натрия на два иона калия (рис. 12).
Активность Na/K-АТФазы в клетке регулируется многими факторами. На первом месте стоят соотношение Na/K и доступность АТФ – это факторы так называемой краткосрочной регуляции активности. Содержание АТФ в клетке, как правило, мало изменяется в нормальных условиях, хотя может резко снижаться при патологических нарушениях. В таком случае снижение уровня АТФ будет критическим для поддержания достаточной активности Na/K-насоса. Соотношение Na/K в клетках зависит от многих факторов и, в свою очередь, является фактором, регулирующим функционирование Na/K-насоса.
2.3. Са2+-АТФаза
Кальциевые АТФазы, входящие в состав цитоплазматических мембран и внутриклеточных мембран, различаются по ряду свойств. Все Са-АТФазы представляют собой мономерные белки, то есть состоят из единственной полипептидной цепи, но несколько различаются по молекулярной массе. Так, Са-АТФаза саркоплазматического ретикулума имеет молекулярную массу 108 кД, а плазматическая Са-АТФаза – 120 кД. Лучше всего изучена Са-АТФаза саркоплазматического ретикулума поперечнополосатых мышц.
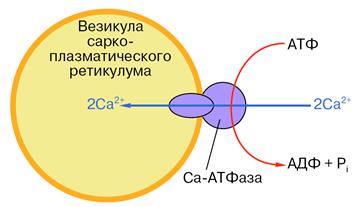
Рис. 13. Схематическое изображение везикулы саркоплазматического ретикулума со встроенной молекулой Са-АТФазы. Во внешнюю среду (цитоплазму) обращена головка фермента диаметром около 9 нм. С ней связываются АТФ и ионы кальция. Мембрану пронизывает канал, по которому, как полагают, кальций переносится при гидролизе АТФ. Более подробная схема строения фермента показана на рис. 15.
Механизм переноса ионов кальция.Каждый цикл переноса включает в себя как минимум три стадии:
1) захватит частицы с одной стороны мембраны,
2) перенес ее через мембрану (транслоцирование),
3) выпуск частицы с другой стороны.
Осуществление этих стадий сопряжено с расходом энергии, и, следовательно, одновременно что-то должно происходить с АТФ. Сама молекула АТФ тоже должна быть захвачена (1) и гидролизована с запасанием энергии и расходом ее на перенос кальция (2), а продукты (АДФ и фосфат) должны перейти из связанного с ферментом состояния в водный раствор (3). В каждом цикле фермент одновременно использует не один, а два субстрата (внутриклеточный кальций и АТФ) и образует три продукта: кальций, накопленный внутри везикул эндоплазматического ретикулума, АДФ и ортофосфат. Усилиями многих ученых была в общих чертах расшифрована последовательность стадий при работе Са-АТФазы (рис. 14), которая включает в себя все перечисленные выше этапы. Работа насоса замечательна еще и тем, что стадии переработки АТФ как бы чередуются со стадиями переноса Са2+. Эти стадии перечислены ниже:
1. связывание двух ионов кальция на поверхности АТФазы, обращенной в цитоплазму (или наружу в изолированных пузырьках СР);
2. связывание на той же поверхности молекулы АТФ;
3. фосфорилирование белка (образование фосфофермента) и высвобождение АДФ;
4. высвобождение ионов кальция с поверхности АТФазы, обращенной внутрь пузырьков СР; связывание магния;
5. гидролиз фосфатной связи и отщепление ионов магния;
6. переход молекулы фермента в исходное состояние (центры связывания кальция оказываются опять на поверхности пузырьков СР).
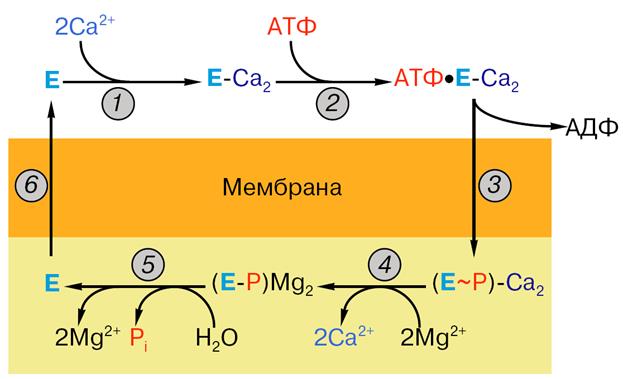
Рис. 14. Последовательность стадий работы Са-АТФазы: 1 – связывание ионов кальция, 2 – связывание АТФ, 3 – образование фосфо-фермента, 4 – отщепление ионов кальция, 5 – гидролиз фосфо-фермента, 6 – возвращение фермента в исходное состояние. Остальные объяснения даны в тексте.
Связывание ионов кальция (1 стадия). К активному центру белка Са2+-АТФазы присоединяется 2 иона Са2+. Установлено, что каждый шестой центр связывания на поверхности молекул АТФазы занят ионами кальция при той чрезвычайно низкой (100 нМ) их концентрации, которая типична для внутриклеточного содержимого.
Связывание АТФ (2 стадия). На поверхности АТФазы имеются центры связывания для двух ионов кальция и одной молекулы АТФ, обладающие высоким сродством к субстрату. Они взаимодействуют между собой, так как связывание Са2+ запускает гидролиз АТФ. При этом было показано, что гидролиз АТФ начинается только после того, как оба иона кальция присоединятся к своим участкам связывания.
Фосфорилирование белка (стадия 3).Гидролиз АТФ осуществляется Са-АТФазой в три этапа. Вначале происходит связывание АТФ, затем фосфорилирование белка и отщепление АДФ и, наконец, гидролитическое расщепление белок-фосфатной связи и высвобождение ортофосфата.
Как известно, при гидролизе АТФ высвобождается большое количество энергии, благодаря чему связь между фосфатом и АДФ в молекуле АТФ называют макроэргической (богатой энергией). Обратимость процесса фосфорилирования белка означает, что и связь фосфата с аспарагиновым остатком в фосфорилированном белке (на рис. 14 она обозначена знаком ~) тоже богата энергией, которая высвобождается при ее гидролизе. Именно эта энергия и тратится на активный перенос ионов кальция.
Высвобождение ионов кальция (стадия 4).Высокоэнергетическая (способная передавать остаток фосфорной кислоты на АДФ) форма фосфорилированной АТФазы стабильна только в присутствии миллимолярных (то есть сравнительно высоких) концентраций ионов Са2+. При меньших концентрациях Са2+ происходит вытеснение ионов Са2+ из Са-связывающих центров фосфофермента ионами Mg2+ (которые присутствуют в среде и без которых Са-АТФаза не работает), ионы кальция при этом выходят в окружающий раствор. Эта стадия работы АТФазы (гидролиз ЕР) – важнейшая в цикле переноса ионов кальция и заслуживает пристального рассмотрения.
Вытеснение ионов Ca2+ из Са-связывающих центров высокоэнергетического фосфопроизводного белка ионами Mg2+ происходит, как выяснилось, не одномоментно, а в два этапа: сначала отщепляется кальций и только потом происходит гидролиз фосфатной связи (отщепление неорганического фосфата):
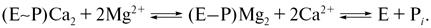
Перенос кальция через мембрану (транслокация).В везикулах саркоплазматического ретикулума молекулы Са-АТФазы ориентированы строго определенным образом, так что связывание ионов кальция и АТФ происходит с наружной стороны пузырьков, а высвобождение кальция – с внутренней. Изучение связывания ионов кальция на разных стадиях работы Са-АТФазы показало, что в нефосфорилированном состоянии Са-связывающие центры АТФазы доступны для ионов Са2+ только с внешней стороны пузырьков и недоступны с внутренней. После фосфорилирования фермента Са-связывающие центры становятся доступными с внутренней стороны и недоступными с внешней. Таким образом, фосфорилирование приводит к переносу центров связывания кальция через мембрану (транслокации). Поскольку перенос ионов осуществляет белковая молекула, очевидно, какие-то ее части должны перемещаться или, как принято говорить, должно происходить изменение конформации белковой молекулы. Одновременно происходит изменение сродства центров связывания к ионам кальция.
Завершение цикла – гидролиз фосфофермента (стадии 5 и 6).Магниевый комплекс энзимфосфата быстро гидролизуется, и фермент приобретает свои исходные свойства (иными словами, восстанавливается исходная конформация ферментного белка). При этом на поверхности фермента, обращенной наружу, вновь появляются центры связывания кальция с высоким сродством. Очевидно, что гидролиз Е-Р приводит, во-первых, к освобождению центров связывания от магния, а во-вторых, к их обратной транслокации (стадия 6). При этом на поверхности фермента, обращенной наружу, центры связывания кальция приобретают вновь высокое сродство к этим ионам. Таким образом, дефосфорилирование Е-Р приводит к пространственным перемещениям участка белковой молекулы и изменениям энергии связывания ионов точно так же, как и фосфорилирование АТФазы, но в противоположном направлении. Цикл работы фермента замыкается (см. рис. 14).
Строение Са2+-АТФазы.Многие ферменты получены в виде кристаллов, и на основании рентгеноструктурного анализа воссоздана их подробная пространственная структура, а подчас и структура их комплексов с субстратами и ингибиторами. К сожалению, транспортные АТФазы, нерастворимые в воде и работающие в составе мембран, не удается получить в виде настоящих кристаллов. Тем не менее, многое об их структуре все же известно, включая последовательность аминокислот в полипептидной цепи, локализацию мест связывания ионов и АТФ в полипептидной цепи и расположение определенных участков цепи по отношению к мембране.
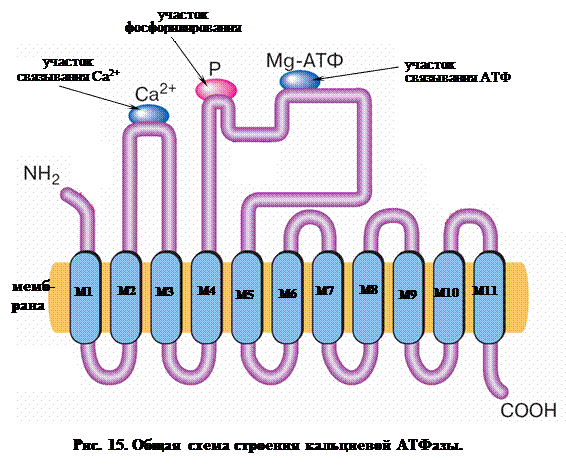
На рис. 15 приведено схематическое изображение Са-АТФазы саркоплазматического ретикулума скелетных мышц. Фермент пронизывает мембрану 11-ю α-спиральными участками, большая часть которых соединена снаружи короткими полипептидными связками, за исключением двух протяженных гидрофильных (то есть хорошо растворимых в воде) петель на стороне цитоплазмы. Более короткая петля расположена между α-спиралями М2 и МЗ, более длинная – между α-спиралями М4 и М5. Длинная петля содержит АТФ-связывающий участок, включающий остаток аспарагиновой кислоты, к которому присоединяется фосфат. Связывание ионов Са2+ происходит на участке, образованном малой петлей (между α-спиралями М2 и МЗ), возможно с участием аминокислотных остатков, прилежащих к спиралям Ml и М4. В местах связывания собрано несколько остатков аспарагиновой кислоты, несущих отрицательные заряды.
Дата добавления: 2015-06-10; просмотров: 5575;
