Некоторые данные о колебательных спектрах биологически важных молекул.
При описании экспериментальных данных пользуемся понятием характеристических колебаний. Это колебания таких отдельных углов и связей, которые в значительной степени не зависят от окружения. Приведем характеристические колебания для некоторых биологически важных веществ.
Рассмотрим колебания пептидной группы. Характеристическими колебаниями являются следующие колебания.
Валентные колебания NH‑связи (3300 см‑1)
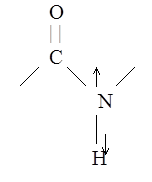
2. Полоса амид 1 (1650 см‑1)
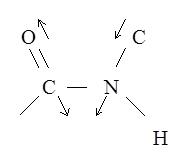
3. Полоса амид 2 (1550 см‑1)
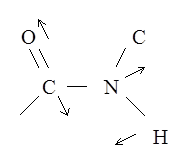
При этих колебаниях смещения атомов лежат в плоскости пептидной группы. Необходимо отметить, что колебания, при которых смещаются протоны можно легко определить экспериментально. При замене водорода на дейтерий частота колебания уменьшается в  раз, поскольку w ~
раз, поскольку w ~ 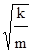 . При разрыве водородной связи происходит изменение константы связи водорода и также изменяется частота колебаний.
. При разрыве водородной связи происходит изменение константы связи водорода и также изменяется частота колебаний.
Интересные возможности для исследования представляет наблюдение ИК-спектров в поляризованном свете. Такие эксперименты помогают установить пространственное расположение связей в нитевидных структурах относительно направления колебаний вектора падающего света.
В колебательных спектрах оснований нуклеиновых кислот можно отметить несколько характерных областей. Область 1750 – 1550 см‑1 — это растяжение СО, CN, СС связей кольца оснований. Область 3500 – 3000 см‑1 — это валентные колебания NH, OH и групп структуры воды, сидящей рядом в ДНК. Область 1240 – 1080 см‑1 — это область симметричных и антисимметричных колебаний группы 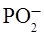 (связи РО). Необходимо особо отметить, что в ИК спектрах поглощения больших молекул (белков и нуклеиновых кислот) колебания отдельных групп трудно идентифицировать.
(связи РО). Необходимо особо отметить, что в ИК спектрах поглощения больших молекул (белков и нуклеиновых кислот) колебания отдельных групп трудно идентифицировать.
Рассмотрим теперь некоторые конкретные применения спектроскопии комбинационного рассеяния в биологических исследованиях.
Современное и детальное описание применений указанного метода приведено в сборнике[1], которому мы и будем следовать в дальнейшем изложении.
Рассмотрим в начале липиды и мембраны.
С помощью комбинационного рассеяния было исследовано, как изменяются физические свойства мембраны (термостабильность, скорость диффузии внутри бислоя и через него и т.д.) в зависимости от свойств индивидуальных липидов, формирующих бислой. Покажем наиболее важные внутримолекулярные колебания, проявляющиеся при исследованиях комбинационного рассеяния фосфолипидов, наиболее важных биологических липидов. Как известно, молекула фосфолипида состоит из жирной кислоты, углеводородного хвоста, полярной “головки”, состоящей из глицерина, фосфата и спирта. Строение и основные характерные изучаемые колебания молекулы фосфолипида – лецитина, показаны на рис.3. Наибольшее число исследований комбинационного рассеяния фосфолипидов посвящено изучению колебаний жирного хвоста. Это происходит по нескольким причинам. Во-первых, эти колебания имеют наибольшую интенсивность в спектре и весьма чувствительны к изменениям структуры. Кроме того известно, что ширина и упорядочение района хвостов играют важную роль в стабильности мембраны.
Колебания различных районов фосфолипида, показанные на рис.3, были идентифицированы с помощью специальных условий (дейтерирование препарата, изучение отдельных компонент и т.д.). Об интенсивностях указанных полос можно судить по спектру комбинационного рассеяния лецитина, показанного на рис.4.
Колебания сжатия и растяжения С‑Н (2850, 2890 см‑1) весьма чувствительны к конфигурации цепи, а также к эффектам окружения.
Количество цис- и трансизомеров в ненасыщенных углеводах в хвосте липида может быть определено сравнением интенсивности полос 1665 см‑1 (цис) и 1670 см‑1 (транс). Низкочастотные колебания решетки включают совместные движения целой цепи. Эти частоты чувствительны к укорочению хвостов липидов при плавлении.
Комбинационное рассеяние света применялось для изучения термических переходов в липидных мембранах на липосомах. Таким способом был продемонстрирован фазовый переход при добавлении полипептида мелиттина (меньше 4 мол %) к липосомам. Мелиттин представляет собой полипептид из 26 аминокислотных остатков, найденный в токсинах пчел. По соотношениям и  было показано увеличение температуры фазового перехода при добавлении мелиттина (28:1) в липосомах из димистроила фосфатидилхолина. Увеличение температуры фазового перехода было объяснено увеличением жесткости липидов при включении полипептидов.
было показано увеличение температуры фазового перехода при добавлении мелиттина (28:1) в липосомах из димистроила фосфатидилхолина. Увеличение температуры фазового перехода было объяснено увеличением жесткости липидов при включении полипептидов.
Рассмотрим теперь особенности комбинационного рассеяния белков.
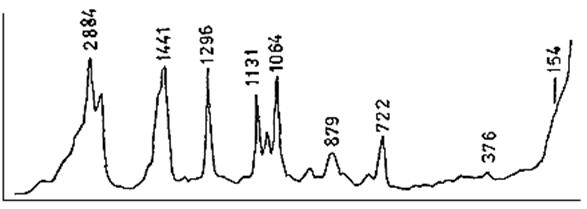
Как известно, третичная структура белка определяет такие свойства как форма белков, растворимость, стабильность, а также влияет на свойства окружения. В белке могут существовать несколько вторичных структур: a-спираль, антипараллельная складчатая b‑структура, а также конформация хаотического клубка. Различия между этими конформациями отражаются во вращательных параметрах. Эти углы показаны
 |
на рис.5.
Колебания основной цепи (так называемые Амид I и Амид III) чувствительны ко вторичной структуре полипептидной цепи. Иногда и колебания боковых аминокислотных остатков могут быть использованы для идентификации этих аминокислот. Хорошей моделью для исследования комбинационного рассеяния белков может служить поли-l-глицин. Он существует в состоянии хаотического клубка при низком рН, a-спирали при высоком рН и низкой температуре и в виде b-структуры при высоких рН и высокой температуре. Наиболее чувствительными к изменениям структуры колебаниями в такой модельной системе являются следующие полосы. Это полоса Амид I (1645–1650 см-1), которая представляет собой в основном сжатие и растяжение С=0 связи, а также полоса Амид III (1235–1300 см-1), которая происходит из суперпозиции растяжения и сжатия CN и NH- связей. Кроме того, к структуре полипептидной цепи чувствительны скелетные колебания растяжения и сжатия С–С связей.
Полоса Амид I чувствительна к различиям между a‑спиралью и b‑структурой: в первой наблюдается поглощение в основном в районе 1640–1655 см-1, а во второй – в1665–1680 см-1. Как b–структура, так и структура хаотического клубка сильно поглощают в области Амид III (1240–1250 см-1), в то время как a–спираль слабо поглощает в этой области.
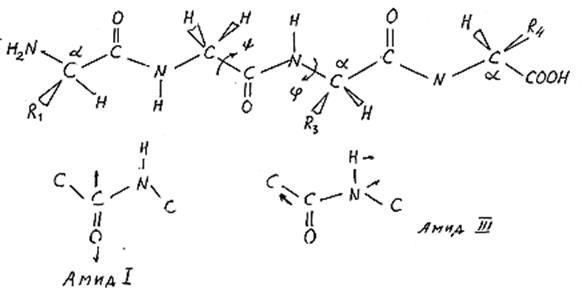
Рассматривая колебания боковых радикалов в полипептидной цепи, необходимо отметить, что колебания колец ароматических остатков тирозина и триптофана весьма чувствительны к окружению этих аминокислот. Более точно, они чувствуют, окружены ли аминокислоты растворителем или же спрятаны в глубине гидрофобных районов белка. На рис.6 показан спектр комбинационного рассеяния белка бычьей панкреатической рибонуклеазы А при 320 С (0,1М NaCl, 0,003М (NH4)2SO4 , pH 5,2), возбуждение лазером при 488 нм. На нем отмечены наиболее характерные частоты колебаний групп, о которых мы уже упоминали.
Рассмотрим теперь спектры комбинационного рассеяния нуклеиновых кислот и полинуклеотидов. Нуклеиновые кислоты- весьма удобный объект для изучения методом комбинационного рассеяния, поскольку они показывают большое число линий, хорошо разрешенных и интенсивных. Эти линии в синтетических полинуклеотидах можно разделить на две большие группы: полосы, связанные с колебаниями сахарно-фосфатного остова и полосы, связанные с колебаниями
 |
оснований. Так, растягивающие и сжимающие колебания сахарного остова между 900 и 1100 см-1 проявляются слабо и мало зависят от структуры полинуклеотида.
В то же время, частоты растягивающих и сжимающих колебаний фосфорно-эфирных связей (при 815 см-1) зависят от природы других сахарных групп и конформации полимера. Определение степени упорядочения полимера- полирибонуклеотида, может быть сделан из соотношения интенсивности полосы 815 см-1 к интенсивности полосы, определяемой симметричными растяжениями и сжатиями PO22- группы (1100 см-1), поскольку эта полоса не зависит от структурных факторов и может служить удобным внутренним стандартом. Так, высоко упорядоченные двойные и односпиральные рибополимеры имеют отношение
I815/ I1100 =1,64, в то время как для неупорядоченных молекул это отношение близко к нулю, поскольку интенсивность линий, связанных с фосфоэфирными связями весьма мала, эта линия заменяется слабой линией при 800 см-1.
На изолированных азотистых основаниях были подробно исследованы характеристические частоты колебаний кольца, которые слабо зависят от вторичной структуры полимера и могут служить для определения содержания каждого основания в полимере. Кроме того, выделенные частоты, интенсивность которых зависит от рН раствора и упорядоченности структуры полинуклеотида. Некоторые колебания показывают увеличение интенсивности при увеличении порядка (гиперхромизм комбинационного рассеяния), а другие- уменьшение интенсивности при увеличении упорядоченности (гипохромизм комбинационного рассеяния). Так, гипохромизм показывает полоса 1230 см-1 урацила, интенсивность полосы спирального полимера (полиRA)(полиRУ) в два раза меньше, чем у денатурированного при комнатной температуре.
Колебания в области 1600–1700 см-1 растяжения и сжатия у карбонильных остатков оснований весьма чувствительны к степени спаривания оснований, к наличию водородных связей.
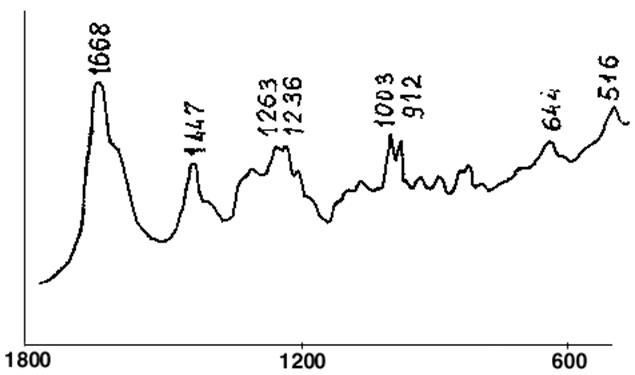
По спектру комбинационного рассеяния ДНК можно отличить различные формы ДНК. Как известно, ДНК наиболее часто существует в двух формах: при низкой влажности (ниже 75%) в «А» форме, а при высокой (98%) – в «В» форме. Наибольшие различия при этом наблюдаются в области 807 см-1 (симметричные колебания растяжения и сжатия фосфатно- эфирных связей). При повышении относительной влажности острый максимум при 807 см-1 исчезает и возникает широкая линия при 835 см-1 (рис.7, а – ДНК при 98% влажности, б – ДНК при 75%, возбуждение лазером при 514,5 нм).
В последнее время получил развитие новый метод комбинационного рассеяния — резонансное комбинационное рассеяние. Оно возникает при возбуждении электронного перехода в хромофоре и сопровождается большим увеличением интенсивности рассеянного света. Резонансная спектроскопия комбинационного рассеяния применяется для изучения белков, содержащих хромоформные группы: металлобелки, белки, содержащие зрительные пигменты. Применяя ультрафиолетовые лазер, можно получить спектры комбинационного рассеяния от аминокислот и нуклеотидов.
 |
Дата добавления: 2015-06-10; просмотров: 1688;
