Орналасу тығыздықғы теориясының көмегімен кристалдану құрылым сипаттау
Көлемді орталықтандырылған тордың бір элементар ұяшығына 2 атом келеді: бір атом куб ортасында және бір атом куб төбесінде орналасқан масса бойынша атомдар қосындысы (куб төбесіндегі әрбір атом сегіз жалғасқан элементар ұяшыққа тиесілі және берілген ұяшыққа осы атомның 1/8 массасы ғана келеді,ал барлық ұяшыққа 1/8=1 атом).
Кубты қырлы орталықтандырылған тордың элементар ұяшығына төрт атом келеді:бір атом (көлемді орталықтандырылған тор сияқты) куб төбесіндегі атомдар және төрт атом қырдың ортасында,өйткені осындай әрбір атом екі торға тиесілі,орналасқан)
Гексагональді тығыз қапталған тордың элементар ұяшығына алты атом сәйкес келеді.(3+1/6*12+1/2*2=6)
Кристалл тор тығыздығы,яғни шартты түрде қатты шарлар ретінде қарастыруға болатын атомдармен толған көлем берілген атомнан тең және ең кіші аралықта орналасқан атомдар саны болып табылатын координациялық санмен сипатталады. Координациялық сан жоғары болған сайын атомдар қаптама тығыздығы жоғары.
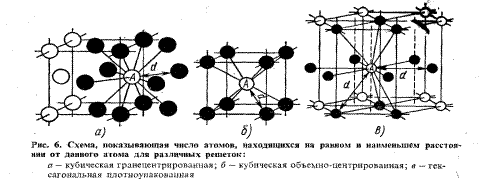
Кубты көлемді орталықтандырылған элементар ұяшықта атомдар арасындағы ең кіші қашықтығы d=(a√3)/2.Берілген атом А қашықтығынан 8 көрші орналасқан(6б сур).Яғни осы тордың координациялық саны 8-ге тен және К8 деп белгіленеді.Атомдармен толған көлемнің ұяшық көлеміне қатынасымен анықталатын ұяшықтың толу коэффициенті 68%.
Қырлы центрленген кристалл тордың координациялық саны 12(К12); әрбір атом d=(a√2)/2 қашықтықта 12 жақын көршіге ие,ол шар түрдегі атомдардың орналасуына және қаптаманың үлкен тығыздығына сәйкес.Гексагональді тығыз қаптамалы тор с/а=1,633 координациялық сан 12 ге тен (Г12),ол да шарлардың үлкен тығыз қаптамасына ие (6сур). Гексагональді жүйеде кристалданатын металдардың көбісінде с/а қатынасы 1,57-1,64 аралығында болады,яғни тығыз каптамадан ауытқу байқалады (с/а=1,633).Егерс/а қатынасы 1,633 мәнінен едәуір айрықша (мысалы цинк және кадмий үшін) болса,гексагональді тордың координациялық саны 6 тен.
Кубты қырлы орталықтандырылған және гексагональді тығыз қаптамалы торлар кішкентай болып табылады,атомдармен толу коэффициенті 74%.
Торда координациялық санның Г12-ден 6 ға дейін төмендегенде толу коэффициенті 50% құрайды,ал координациялық сан 4 тен кезде 25% шамасында.
Периодты жүйеде металдар мен бейметалдар аралығындағы элементтерде кіші координациялық санға ие қиын кристалдық тор болады.
VII,VI,V, және кейде IV топ жартылай және бейметалл элементтердің кристалдық құрылым координациялық саны 8-N ережесі бойынша табылуы мүмкін,мұндағы N-берілген элемент орналасқан периодтық жүйенің топ саны.Осылайша мысалы Аs, Sb, Bi V топқа тиесілі сондықтан координациялық сан 3 тен.
Атомдар орталықтары арасындағы ең кіші арақашықтық жартысы атом радиусы деп аталады. Атом радиусы координациялық сан азайғанда өседі,өйткені атомдар арасындағы кеңістік өседі.Осыған байланысты әр түрлі металдардың атом радиусы шамасы әдетте К12 тен.
Бақылау сұрақтар:
1.Атом радиусы дегеніміз не?
2.Тығыз қаптама теориясы нені білдіреді?
3. Кристалл тордың координациялық саны.
4.Кристалл денелердің шағындылық коэффициенті.
5. полиэдр дегеніміз не?
Дата добавления: 2015-06-10; просмотров: 2283;
