Эффект Джоуля — Томсона
Если идеальный газ адиабатически расширяется и совершает при этом работу, то он охлаждается, так как работа в данном случае совершается за счет его внутренней энергии (см. § 55). Подобный процесс, но с реальным газом — адиабатическое расширение реального газа с совершением внешними силами положительной работы — осуществили английские физики Дж. Джоуль (1818—1889) и У. Томсон (лорд Кельвин, 1824—1907).
Рассмотрим эффект Джоуля — Томсона. На рис. 93 представлена схема их опыта. В теплоизолированной трубке с пористой перегородкой находится два поршня, которые могут перемещаться без трения. Пусть сначала слева от перегородки газ под поршнем 1 находится под давлением р1, занимает объем V1при температуре Т1, а справа газ отсутствует (по-
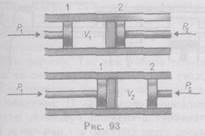
ршень 2 придвинут к перегородке). После прохождения газа через пористую перегородку в правой части газ характеризуется параметрами р2, V2, Т2. Давления р1и р2 поддерживаются постоянными (р1>р2).
Так как расширение газа происходит без теплообмена с окружающей средой (адиабатически), то на основании первого начала термодинамики
dQ=(U2-U1)+dA=0. (64.1)
Внешняя работа, совершаемая газом, состоит из положительной работы при движении поршня 2 (A2=p2V2) и отрицательной при движении поршня 1 (A1=p1V1), т.е. dA=A2-А1. Подставляя выражения для работ в формулу (64.1), получим
U1+p1V1=U2+p2V2. (64.2)
Таким образом, в опыте Джоуля — Томсона сохраняется (остается неизменной) величина U+pV. Она является функцией состояния и называется энтальпией.
Ради простоты рассмотрим 1 моль газа. Подставив в формулу (64.2) выражение (63.3) и рассчитанные из уравнения Ван-дер-Ваальса (61.2) значения p1V1 и p2V2(символ «m» опять опускаем) и производя элементарные преобразования, получим
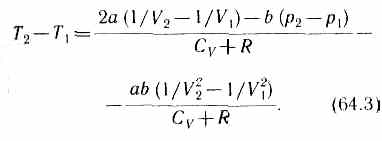
Из выражения (64.3) следует, что знак разности (T2-T1) зависит от того, какая из поправок Ван-дер-Ваальса играет большую роль. Проанализируем данное выражение, сделав допущение, что p2<<p1
и V2>>V1:
1) a»0— не учитываем силы притяжения между молекулами, а учитываем лишь размеры самих молекул. Тогда
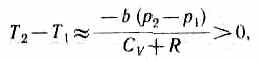
т. е. газ в данном случае нагревается;
2) b»0 - не учитываем размеров молекул, а учитываем лишь силы притяжения между молекулами. Тогда
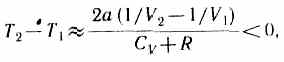
т. е. газ в данном случае охлаждается;
3) учитываем обе поправки. Подставив в выражение (64.3) вычисленное из уравнения Ван-дер-Ваальса (61.2) значение p1, имеем
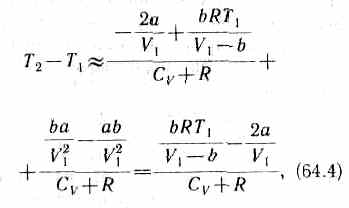
т. е. знак разности температур зависит от значений начального объема V1и начальной температуры Т1.
Изменение температуры реального газа в результате его адиабатического расширения, или, как говорят, адиабатического дросселирования— медленного прохождения газа под действием перепада давления сквозь дроссель(например, пористую перегородку), называется эффектом Джоуля — Томсона.Эффект Джоуля — Томсона принято называть положительным,если газ в процессе дросселирования охлаждается (DT<0), и отрицательным,если газ нагревается (DT>0).
В зависимости от условий дросселирования для одного и того же газа эффект Джоуля — Томсона может быть как положительным, так и отрицательным. Температура, при которой (для данного давления) происходит изменение знака эффекта Джоуля — Томсона, называется температурой инверсии.
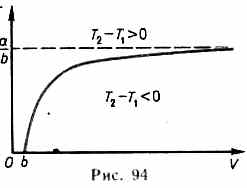
Ее зависимость от объема получим, приравняв выражение (64.4) нулю:
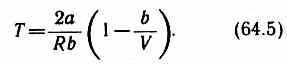
Кривая, определяемая уравнением (64.5),— кривая инверсии— приведена на рис. 94. Область выше этой кривой соответствует отрицательному эффекту Джоуля — Томсона, ниже — положительному. Отметим, что при больших перепадах давления на дросселе температура газа изменяется значительно. Так, при дросселировании от 20 до 0,1 МПа и начальной температуре 17 °С воздух охлаждается на 35 °С.
Эффект Джоуля — Томсона обусловлен отклонением газа от идеальности. В самом деле, для моля идеального газа pVm = RT, поэтому выражение (64.2) примет вид
CVT1+RT1=CVT2 + RT2, откуда следует, что T1=T2
Дата добавления: 2015-06-10; просмотров: 1461;
