Внутренняя энергия реального газа
Внутренняя энергия реального газа складывается из кинетической энергии теплового движения его молекул (определяет внутреннюю энергию идеального газа, равную CVT; см. § 53) и потенциальной энергии межмолекулярного взаимодействия. Потенциальная энергия реального газа обусловлена только силами притяжения между молекулами. Наличие сил притяжения приводит к возникновению внутреннего давления на газ (см. (61.1)):
p'=a/V2m
Работа, которая затрачивается для преодоления сил притяжения, действующих между молекулами газа, как известно из механики, идет на увеличение потенциальной энергии системы, т. е. dA=p'dVm=dП, или dП=(a/V2m)dVm, откуда
П=-a/Vm
(постоянная интегрирования принята равной нулю). Знак минус означает, что молекулярные силы, создающие внутреннее давление р', являются силами притяжения (см. § 60).
Учитывая оба слагаемых, получим, что внутренняя энергия моля реального газа
Um = CVT-a/Vm (63.1)
растет с повышением температуры и увеличением объема.
Если газ расширяется без теплообмена с окружающей средой (адиабатический процесс, т. е. dQ = 0) и не совершает внешней работы (расширение газа в вакуум, т. е. dA=0), то на основании первого начала термодинамики (dQ=(U2-U1)+dA) получим, что
U1=U2. (63.2)
Следовательно, при адиабатическом расширении без совершения внешней работы внутренняя энергия газа не изменяется.
Равенство (63.2) формально справедливо как для идеального, так и для реального газов, но физически для обоих случаев совершенно различно. Для идеального газа равенство U1=U2означает равенство температур (Т1=Т2), т. е. при адиабатическом расширении идеального газа в вакуум его температура не изменяется. Для реального газа из равенства (63.2), учитывая, что для моля газа
U1=CVT1-a/V1, U2=CVT2-a/V2,
(63.3) получаем
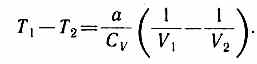
Так как V2>V1, то Т1>Т2, т. е. реальный газ при адиабатическом расширении в вакуум охлаждается. При адиабатическом сжатии реальный газ нагревается.
Дата добавления: 2015-06-10; просмотров: 1456;
