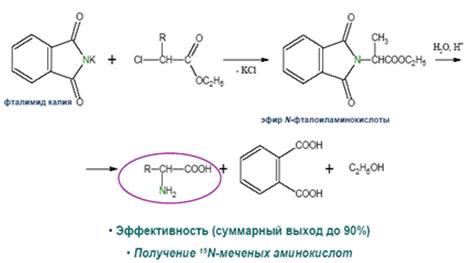
Аминирование галогенокислот фталимидом
Аминокислоты можно получать химическим синтезом, с последующей трансформацией с помощью микроорганизмов или ферментов, выделенных из них гидролизом природных белков, микробиологическим синтезом.
Более 60% всех производимых промышленностью чистых препаратов аминокислот получают путем микробиологического синтеза. На втором месте по объему производства находится химический синтез.
Синтез целого ряда аминокислот химическим путем хорошо изучен и введен в производство. Во многих случаях такое производство экономически выгодно. Но в процессе химического синтеза преимущественно образуются рацематы – смесь D – и L – форма аминокислот.
D-форма не имеет физиологической ценности для человека и животных: она не включается в обмен веществ и не усваивается. Очистка продукта от D-формы приводит к значительным экономическим издержкам и усложнению производства.
Преимущественно химическим путем в промышленности производится глицин, DL-метионин, L-фенилаланин, L-валин, L-треонин, L-триптофан.
Основным недостатком химического синтеза является получение смеси аминокислот, состоящей из изомеров, относящихся как к D – так и к L – ряду, тогда как биологической активностью в организме человека и животных обладают лишь L-формы. D – формы аминокислот не превращаются ферментными системами этих организмов, а некоторые из них токсичны для человека и животных. Исключением является аминокислота – метионин, у которой биологически активные как D – так и к L – формы, в связи с чем данная аминокислота производится преимущественно методом химического синтеза.
Сначала происходит окислительное дезаминирование с помощью специфической D-аминокислотной оксидазы. Затем полученная α- кетокислота стереоспецифически переаминируется в L-аминокислоту. Вообще говоря, HAKможно заменить промежуточными продуктами их биосинтеза, например соответствующими кетокислотами.
Технологически получение аминокислот гидролизом белков экономически менее выгодно, поэтому не получило широкого распространения.
Физиологически активные L-формы получают в промышленном масштабе путем кислотного и щелочного гидролиза природных белков. Наиболее подходящим сырьем для данного процесса являются отходы различных производств, в том числе непищевых (например, кератинсодержащие отходы). Но этот метод имеет определенные недостатки: высокая стоимость процесса гидролиза, сложность удаления необходимой аминокислоты из смеси аминокислот гидролизата, разрушение части аминокислот в процессе гидролиза и ограниченность сырьевых ресурсов. Преимуществом способа является трансформация отходов непищевых производств в полезный продукт.
Производство аминокислот из белкового гидролизата, как способ получения L-аминокислот в настоящее время имеет лишь ограниченное значение, хотя по-прежнему является основным для производства L-серина, L-пролина, L-оксипролина и L-тирозина. Он не подходит для крупномасштабного производства аминокислот.
Промышленное использование ферментов для производства L-аминокислот началось почти 40 лет назад в Японии с разрешением использования N-ацетил-DL-аминокислот, образованных с помощью иммобилизованной ацилазы. Это послужило началом перспективного метода получения аминокислот, которое известно, как разделение рацематов. Метод осуществляется путем ассиметричного гидролиза производных аминокислот с использованием микроорганизмов, обладающих специфической L-ацилазной, L- амидазной, L- эстеразной активностью.
Ферментативное разделение рацематов аминокислот с L-ацилазами основано на избирательном гидролизе ацилированных производных L-аминокислот. При отщеплении ацильной группы L-аминокислоты становятся более растворимыми и легко отделяются от малорастворимых ацилированных D-аминокислот. Не прореагировавшие производные D-аминокислот могут быть подвергнуты рацемизации и вновь использованы для ферментативного разделения.
Для производства L-метионина используется метод, при котором применяется ацилаза, выделенная из микроорганизмов Aspergillus оryzae, а процес осуществляется в ферментном мембранном реакторе (ФМР). Ежегодно проводится получение нескольких сотен тонн L-метионина и L-валина с использованием ФМР технологии.
Ферментативный синтез аминокислот основывается на процессах с использованием выделенных в индивидуальном виде ферментов, как правило, закрепленных (иммобилизованных) на инертном носителе.Процесс получения аминокислот заключается в синтезе предшественника аминокислоты и последующей его трансформации в целевую аминокислоту с использованием либо выделенных ферментов, либо микроорганизмов.
Преимущественно ферментативным путем производится L-аспарагиновая кислота. Аспартаза в присутствии аммиака катализирует прямое преобразование фумаровой кислоты в L-аспартат, который нужен в больших количествах для подсластителя аспартама. L-аспартат является также исходным материалом для ферментативного производства L-аланина с использованием иммобилизованной аспартат-β-декарбоксилазы.
Для L-цистеина, который ранее производился главным образом путем электрохимического восстановления L-цистина полученного гидролизом белков, существует промышленный ферментативный процесс, в котором производная тиазолина DL-2-амино-2-тиазолин-4-карбоновая кислота (АТК) превращается в L-цистеин с помощью трех ферментов (L-ATC гидролазы, S-карбамоил-L-цистеин гидролазы и АТК рацемазы), выделенных из Pseudomonas thiazolinophilum.
Ферментативные методы получения аминокислот имеют ряд преимуществ:
• Высокая концентрация веществ в перерабатываемых смесях приводит к значительному уменьшению габаритов используемого оборудования, а также к упрощению процессов выделения и очистки полупродуктов и целевых продуктов синтеза.
• Отсутствие опасности заражения технологической линии посторонними микроорганизмами и, как следствие, возможность проведения процесса в нестерильных условиях (но требования к чистоте исходного сырья и технологических линий при работе с ферментами высокие).
Широкое применение ферментов в крупномасштабном производстве ограничено их труднодоступностью и высокой стоимостью, низкой стабильностью и чувствительностью даже в иммобилизованном виде ко многим внешним факторам.
Микробиологический метод получения аминокислот, наиболее распространенный в настоящее время, основан на способности микроорганизмов синтезировать все L-аминокислоты, а в определенных условиях – обеспечивать их сверхсинтез. Биосинтез аминокислот в микробных клетках протекает в виде так называемых свободных аминокислот или «пула аминокислот», из которого в процессах конструктивного метаболизма синтезируются клеточные макромолекулы.
Пути синтеза большинства аминокислот взаимосвязаны. При этом одни аминокислоты являются предшественниками для биосинтеза других.
Синтез каждой аминокислоты в микробных клетках реализуется в строго определенных количествах, обеспечивающих образование последующих аминокислот, и находится под строгим генетическим контролем. Контроль осуществляется по принципу обратной связи на уровне генов, ответственных за синтез соответствующих ферментов (репрессия), и на уровне самих ферментов, которые в результате избытка образующихся аминокислот могут изменять свою активность (ретроингибирование). Данный механизм контроля исключает перепроизводство аминокислот и также препятствует их выделению из клеток в окружающую среду. Чтобы добиться сверхсинтеза отдельных аминокислот, нужно обойти или изменить данный контрольный механизм их синтеза. Для первого пути возможно использование природных «диких» штаммов, в этом случае существенны условия ферментации, так как добиться дисбаланса в системе синтеза аминокислот можно путем изменения ряда основных факторов среды (концентрация основного субстрата, рН, соотношение макро- и микроэлементов в среде и др.). Изменение контрольного механизма синтеза аминокислот осуществляется генетическими методами. При этом получают мутантные организмы: ауксотрофные и регуляторные мутанты.
Ауксотрофные мутанты – это организмы, утратившие способность к синтезу одной или нескольких аминокислот. Их используют в тех случаях, когда необходимо синтезировать аминокислоты, являющиеся конечными продуктами разветвленных цепей метаболических реакций аминокислот. Например, для получения L-лизина, L-треонина, L-метионина или L-изолейцина, для которых общим предшественником является L-аспартат, применяют мутанты, ауксотрофные по гомосерину или треонину и гомосерину. Ауксотрофные мутанты не способны образовывать ингибиторы соответствующего метаболического пути, работающие по принципу отрицательной обратной связи из-за отсутствия определенной ключевой ферментативной реакции. Поэтому при выращивании такого штамма микроорганизмов в среде с минимальной концентрацией необходимого ингредиента (аминокислоты) они способны на суперпродукцию аминокислоты-предшественника.
Регуляторные мутанты – мутанты с частично нарушенной регуляцией биосинтеза. Регуляторные мутанты отбирают по устойчивости к аналогам аминокислот либо среди ревертантов ауксотрофов. Аналоги аминокислот выступают в роли искусственных ингибиторов ферментов, работающих по принципу обратной связи, одновременно обеспечивая биосинтез требуемых аминокислот и подавляя процесс их включения в белки.
В последние годы для получения новых эффективных штаммов продуцентов аминокислот стали применять новейшие методы биотехнологии. Методы генетической инженерии позволяют повышать количество генов биосинтеза путем их клонирования на плазмидах. Это приводит к увеличению количества ферментов, ответственных за синтез аминокислот, следовательно, повышает выход целевого продукта. Клонирование генов системы синтеза аминокислот в клетки микроорганизмов с иным, по сравнению с донорским организмом, типом питания позволяет расширять сырьевую базу и заменять дорогостоящие сахаросодержащие субстраты более дешевыми.
До сих пор большинство штаммов-продуцентов BCAA (ВСАА - от англ. Branched-chain amino acids: L-валин, L-лейцин и L-изолейцин) были разработаны путем случайного мутагенеза. Этот классический подход был успешным, как и для других продуцентов аминокислот, но он имеет некоторые недостатки. Генетические изменения, вызванные мутагенезом, могут касаться тех частей генетического аппарата клетки, которые непосредственно не связаны с биосинтезом аминокислоты, в результате чего могут произойти нежелательные изменения в клеточной физиологии. Очень трудно осуществить дальнейшее улучшение штаммов со случайными мутациями. Лучшим решением этой проблемы является конструирование штаммов-продуцентов аминокислот с использованием методов рациональной метаболической инженерии. Чаще всего это осуществляется путем блокирования конкурирующего пути и с помощью гиперэкспрессии генов биосинтеза.
Аминокислоты L-фенилаланин и L-цистеин, которые ранее изготавливались в основном с помощью ферментов, теперь могут быть получены более экономически эффективным путем ферментации с использованием штаммов Escherichia coli и, таким образом, стать более доступными для растущего рынка. Почти все протеиногенные аминокислоты, за немногими исключениями, могут быть изготовлены промышленным способом специально разработанными мутантными штаммами Corynebacterium glutamicum и E. coli.
Дата добавления: 2015-06-05; просмотров: 3792;
